Keine Artikel in Ihrem Warenkorb
Ammoniumpersulfat
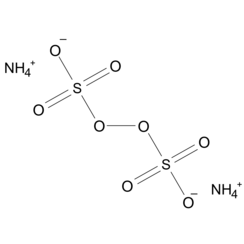
Ammoniumpersulfat (APS) ist die anorganische Verbindung mit der Formel (NH4) 2S2O8. Es ist ein farbloses (weißes) Salz, das in Wasser sehr gut löslich ist, viel mehr als das verwandte Kaliumsalz. Es ist ein starkes Oxidationsmittel, das in der Polymerchemie, als Ätzmittel und als Reinigungs- und Bleichmittel verwendet wird.
Die Auflösung des Salzes in Wasser ist ein endothermer Prozess.
Als Oxidationsmittel und Radikalquelle findet APS viele kommerzielle Anwendungen.
Sulfatsalze werden hauptsächlich als Radikalinitiatoren bei der Polymerisation bestimmter Alkene verwendet. Kommerziell wichtige Polymere, die unter Verwendung von Persulfaten hergestellt werden, umfassen Styrol-Butadien-Kautschuk und Polytetrafluorethylen. In Lösung dissoziiert das Dianion unter Bildung von Radikalen:
[O3SO - OSO3] 2− ⇌ 2 [SO4] -
Das Sulfatradikal addiert sich zum Alken, um ein Sulfatesterradikal zu ergeben. Es wird auch zusammen mit Tetramethylethylendiamin verwendet, um die Polymerisation von Acrylamid bei der Herstellung eines Polyacrylamidgels zu katalysieren, was für SDS-PAGE und Western Blot wichtig ist.
Als Beispiel für seine starken oxidierenden Eigenschaften wird es zum Ätzen von Kupfer auf Leiterplatten als Alternative zur Eisenchloridlösung verwendet. Diese Eigenschaft wurde vor vielen Jahren entdeckt. 1908 verwendete John William Turrentine eine verdünnte Ammoniumpersulfatlösung, um Kupfer zu ätzen. Turrentin wog die Kupferspiralen, bevor die Kupferspiralen eine Stunde lang in die Ammoniumpersulfatlösung gegeben wurden. Nach einer Stunde wurden die Spiralen erneut gewogen und die durch Ammoniumpersulfat gelöste Kupfermenge aufgezeichnet. Dieses Experiment wurde auf andere Metalle wie Nickel, Cadmium und Eisen ausgedehnt, die alle ähnliche Ergebnisse lieferten. Die Oxidationsgleichung lautet also: S.2O2−8 (aq) + e - → 2 SO2 -4 (aq).
Ammoniumpersulfat ist ein Standardbestandteil in Haarbleiche.
Persulfate werden in der organischen Chemie als Oxidationsmittel eingesetzt. Zum Beispiel in der Minisci-Reaktion.