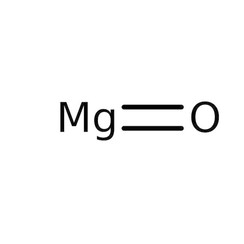Keine Artikel in Ihrem Warenkorb
Magnesiumoxid
Magnesiumoxid (Magnesia), veraltet auch Bittererde, ist das Oxid des Magnesiums. Das Salz besitzt die Formel MgO und besteht aus Mg2+- und O2−-Ionen. Es kristallisiert in der Natriumchlorid-Struktur.
Es wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 530 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
Für technische Anwendungen wird Magnesiumoxid in leicht verunreinigter Form als kaustisch gebrannter Magnesit (KM) angeboten und dient zur Gewinnung von Buntmetallen, Stahlveredlern und Glas. Vermischt mit Magnesiumchlorid oder -sulfatlösungen wird kaustisch gebrannter Magnesit als sogenannter Sorelzement etwa zur Herstellung von Industriefußböden verwendet. Solcher Magnesiazement verbindet sich gut mit organischen porösen Substanzen wie Holz, Kork und Leder. Im Bausektor kommt Magnesiumoxid auch als Bindemittel für mineralische Ortschäume zum Einsatz.
Kaustisch gebrannter Magnesit wird auch in der Dünge- und Futtermittelindustrie als Magnesiumträger verwendet.
In der Medizin wird Magnesiumoxid zur Substitutionstherapie verwendet.
Sintermagnesia wird aufgrund des hohen Schmelzpunkts von 2800 °C zur Herstellung von Magnesia-Kohlenstoff-Steinen verwendet, die zu den basischen Feuerfestmaterialien zählen. Endprodukte sind etwa feuerfeste Auskleidungen von Laborgeräten, Gefäßen wie Konvertern, Elektrolichtbogenöfen, Gießpfannen in der Stahlerzeugung, isolierende Umhüllung von Thermoelementen und Isolierröhrchen zwischen Heizfaden und Kathode von Elektronenröhren.
Magnesiumoxid wird auch zur Entkieselung von Wasser sowie als Adsorptionsmittel und Vulkanisierungsverzögerer in der organischen Chemie eingesetzt.
Zur Boraxperlen-Probe werden gesinterte Magnesiastäbchen von 1–2 mm Durchmesser eingesetzt, deren genutztes Ende leicht abzubrechen ist.
Gepresstes feines Pulver aus MgO wird auch als Tafelkreide in der Schule benutzt.