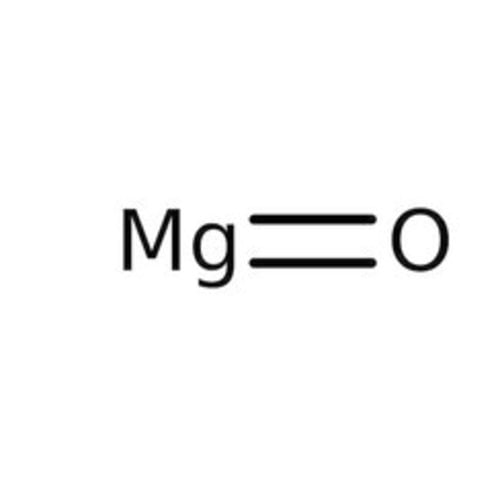Keine Artikel in Ihrem Warenkorb
Magnesiumoxid 98+ % Ph. EUR. leicht
- Kaufen Sie 2 und sparen Sie 5%
- Kaufen Sie 6 und sparen Sie 10%
Was ist Magnesiumoxid
Magnesiumoxid, allgemein als Magnesia bezeichnet, hat die Formel MgO und liegt in Form eines basischen weißen Pulvers vor, das Wasser und Kohlendioxid in der Atmosphäre absorbiert.
Das meiste Magnesiumoxid wird derzeit aus Magnesiumcarbonat MgCO3 gewonnen, das bestimmte Mineralien wie Magnesit bildet, oder aus unterirdisch aus Meerwasser oder Sole gewonnenem Magnesiumchlorid.
Der erste Weg verwendet eine einfache Kalzinierung: Magnesiumcarbonat, erhitzt von 700 auf 1000 ° C, zerfällt in Magnesiumoxid und Kohlendioxid:
MgCO3 → MgO + CO2.
Der zweite Weg umfasst zwei Schritte:
Magnesiumhydroxid Mg(OH)2 wird durch Zugabe von Kalk zu einer in Magnesiumchlorid konzentrierten Sole ausgefällt:
MgCl2 + CaO + H2O → Mg(OH)2 + CaCl2;
die Calcinierung des so erhaltenen Magnesiumhydroxids ergibt das Magnesiumoxid:
Mg(OH)2 → MgO + H2O.
Die Eigenschaften des erhaltenen Magnesiumoxids sind stark abhängig von der Temperatur, bei der die Kalzinierung durchgeführt wird:
zwischen 700°C und 1000°C wird ein Produkt erhalten, das in vielen industriellen Anwendungen verwendet wird, beispielsweise als Pigment für Farben, Füllstoff für Papier und bestimmte synthetische Materialien, Neutralisationsmittel;
zwischen 1.000 °C und 1.500 °C wird ein chemisch weniger reaktives Produkt erhalten, das sich sehr gut für Anwendungen eignet, die einen langsamen Abbau erfordern: Düngemittel, Nahrungsergänzungsmittel für Vieh;
zwischen 1.500 °C und 2.000 °C wird das erhaltene Magnesiumoxid als „gesintert“ bezeichnet und ist auch bei sehr hohen Temperaturen besonders stabil. Es wird hauptsächlich als feuerfestes Material verwendet: Ziegel für den Bau von Öfen, Auskleidung von Tiegeln in der Metallurgie, feuerfestes Produkt für die Bauindustrie.
Magnesiumoxid wird auch als Rohstoff für die Herstellung von Salzen wie Magnesiumnitrat und -sulfat verwendet. Es wird auch für die industrielle Herstellung von Magnesium verwendet. Es wird dann in einem Elektroofen bei 1100 °C in Gegenwart von Silizium gemäß der Reaktion reduziert:
2MgO(s) + Si(l) → 2Mg(g) + SiO2(l).
Magnesiumoxid findet auch therapeutische Anwendung als Antazida, um Sodbrennen zu lindern. In Lebensmitteln wird es als Lebensmittelzusatzstoff verwendet und unter der Nummer E530 reguliert. Es ist ein Trennmittel.
Magnesiumoxid kaufen?
Magnesiumoxid in pharmazeutischer Qualität können Sie bei Laboratoriumdiscounter kaufen. Magnesiumoxid in europäischer Qualität. Schnell geliefert und immer mit Mengenrabatt!
Technische Daten:
Magnesia brennt
Summenformel MgO
Molmasse (M) 40,30 g/mol
Dichte (D) 3,58 g/cm³
Siedepunkt (Siedepunkt) 3600 °C
Schmelzpunkt (Fp.) ~2800 °C
WKK 1
CAS-Nr. [1309-48-4]
EG-Nr. 215-171-9
Downloads