No tiene ningún artículo en su cesta
Persulfato de amonio
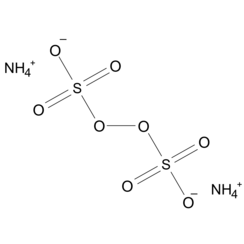
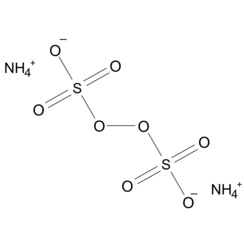
El persulfato de amonio (APS) es el compuesto inorgánico de fórmula (NH4) 2S2O8. Es una sal incolora (blanca) que es muy soluble en agua, mucho más que la sal de potasio relacionada. Es un fuerte agente oxidante utilizado en la química de polímeros, como grabador y como agente limpiador y blanqueador.
La disolución de la sal en agua es un proceso endotérmico.
Como oxidante y fuente de radicales, APS tiene muchas aplicaciones comerciales.
Las sales de sulfato se utilizan principalmente como iniciadores de radicales libres en la polimerización de ciertas olefinas. Los polímeros comercialmente importantes preparados con persulfatos incluyen caucho de estireno-butadieno y politetrafluoroetileno. En solución, el dianión se disocia para dar radicales:
[O3SO - OSO3] 2− ⇌ 2 [SO4] • -El radical sulfato se agrega al alqueno para dar un radical éster sulfato. También se usa junto con tetrametiletilendiamina para catalizar la polimerización de acrilamida en la fabricación de gel de poliacrilamida y, por lo tanto, es importante para SDS-PAGE y Western Blot.
Ilustrativo de sus poderosas propiedades oxidantes, se utiliza para grabar cobre en placas de circuito impreso como alternativa a la solución de cloruro férrico. Esta propiedad fue descubierta hace muchos años. En 1908, John William Turrentine utilizó una solución diluida de persulfato de amonio para grabar el cobre. Turrentin pesó bobinas de cobre antes de colocar las bobinas de cobre en la solución de persulfato de amonio durante una hora. Después de una hora, se volvieron a pesar las bobinas y se registró la cantidad de cobre disuelto por persulfato de amonio. Este experimento se extendió a otros metales como el níquel, el cadmio y el hierro, todos los cuales dieron resultados similares. Entonces, la ecuación de oxidación es: S2O2−8 (aq) + e− → 2 SO2−4 (aq).
El persulfato de amonio es un ingrediente estándar en la decoloración del cabello.
Los persulfatos se utilizan como agentes oxidantes en química orgánica. Por ejemplo, en la reacción de Minisci.