No tiene ningún artículo en su cesta
1,4-ditiotreitol (DTT)
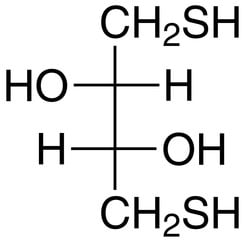
Ditiotreitol (DTT) es el nombre común de un reactivo redox de molécula pequeña, también conocido como reactivo de Cleland. La fórmula del ditiotreitol es C4H10O2S2 y la estructura química de uno de sus enantiómeros en forma reducida se muestra a la derecha; la forma oxidada es un anillo de 6 miembros con enlaces disulfuro. El reactivo se usa a menudo en su forma racémica porque ambos enantiómeros son reactivos. Su nombre se deriva del azúcar cuádruple, threose. DTT tiene una conexión epimérica ('hermana'), ditioeritritol (DTE)
El DTT se utiliza como agente reductor o agente "desprotector" del ADN tiolado. Los átomos de azufre terminales del ADN tiolado tienden a formar dímeros en solución, especialmente en presencia de oxígeno. La dimerización reduce significativamente la eficacia de las reacciones de acoplamiento posteriores, como la inmovilización de ADN sobre oro en biosensores. Normalmente, el ditiotreitol se mezcla con una solución de ADN y luego se elimina por filtración (para el catalizador sólido) o por cromatografía (para la forma líquida). El procedimiento de eliminación de TDT a menudo se denomina "desalación". En general, el DTT se utiliza como agente protector que previene la oxidación de los grupos tiol.
El DTT se utiliza a menudo para reducir los enlaces disulfuro de proteínas y, más generalmente, para evitar que se formen enlaces disulfuro intramoleculares e intermoleculares entre residuos de cisteína de proteínas. Pero incluso el DTT no puede reducir los enlaces disulfuro enterrados (inaccesibles al disolvente), por lo que la reducción de los enlaces disulfuro a veces se realiza en condiciones de desnaturalización (p. Ej., A altas temperaturas o en presencia de un desnaturalizante fuerte como cloruro de guanidinio 6 M, urea 8 M o dodecil sulfato de sodio al 1%) . El DTT se usa a menudo junto con dodecilsulfato de sodio en SDS-PAGE para desnaturalizar aún más las proteínas al reducir sus enlaces disulfuro para permitir una mejor separación de las proteínas durante la electroforesis. Debido a su capacidad para reducir los enlaces disulfuro, el DTT se puede utilizar para desnaturalizar el CD38 en los glóbulos rojos. Por el contrario, la exposición de diferentes enlaces disulfuro al disolvente puede determinarse por su tasa de disminución en presencia de DTT.
El DTT también se puede utilizar como agente oxidante. La principal ventaja es que, de hecho, no se pueblan especies mixtas de disulfuro, a diferencia de otros agentes como el glutatión. En casos muy raros, se puede formar un aducto de DTT, es decir, los dos átomos de azufre de DTT pueden formar enlaces disulfuro con diferentes átomos de azufre; en tales casos, DTT no puede ciclar porque no tiene tales tioles libres residuales