No tiene ningún artículo en su cesta
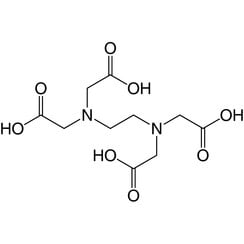
Ácido etilendiaminotetraacético (EDTA)
El ácido etilendiaminotetraacético (EDTA), también conocido por varios otros nombres, es una sustancia química que se utiliza tanto para fines industriales como médicos. Fue sintetizado por primera vez en 1935 por Ferdinand Münz.
Es un ácido aminopolicarboxílico y un sólido soluble en agua e incoloro. La base conjugada es etilendiaminotetraacetato. Se utiliza mucho para disolver la cal. Su utilidad se deriva de su función como ligando hexadentado ("seis posiciones") y agente quelante, es decir, su capacidad para fijar iones metálicos como Ca2 + y Fe3 +. Después de unirse a un complejo metálico por EDTA, los iones metálicos permanecen en solución pero muestran una reactividad reducida. El EDTA se produce como una variedad de sales, en particular EDTA disódico, EDTA cálcico disódico y EDTA tetrasódico (típicamente como un hidrato).
Aplicaciones
-Industria
En la industria, el EDTA se utiliza principalmente para almacenar iones metálicos en solución acuosa. En la industria textil, evita que los contaminantes de iones metálicos alteren los colores de los productos teñidos. En la industria de la pulpa y el papel, el EDTA inhibe la capacidad de los iones metálicos, especialmente Mn2 +, para catalizar la desproporción del peróxido de hidrógeno, que se utiliza en el blanqueo sin cloro. De manera similar, se agrega EDTA a algunos alimentos como conservante o estabilizador para evitar la decoloración oxidativa catalítica, que es catalizada por iones metálicos. En los refrescos que contienen ácido ascórbico y benzoato de sodio, el EDTA reduce la formación de benceno (un carcinógeno).
La reducción de la dureza del agua en las aplicaciones de lavado y la disolución de los depósitos de sarro en las calderas dependen del EDTA y los complejantes relacionados para unir Ca2 +, Mg2 + y otros iones metálicos. Una vez unidos al EDTA, estos centros metálicos tienden a no precipitar ni interferir con la acción de los jabones y detergentes. Por razones similares, las soluciones de limpieza a menudo contienen EDTA. De manera similar, el EDTA se utiliza en la industria del cemento para la determinación de cal libre y magnesia libre en cemento y clínker.
La solubilidad de los iones Fe3 + a un pH casi neutro o inferior se puede lograr con EDTA. Esta propiedad es útil en agricultura, incluida la hidroponía. Sin embargo, dada su dependencia del pH de la formación de ligandos, el EDTA no es útil para mejorar la solubilidad del hierro en suelos neutrales. De lo contrario, el hierro (III) se forma a un pH casi neutro y sales insolubles más altas, que son menos biodisponibles para las especies de plantas sensibles. Acuoso [Fe (EDTA)]: se utiliza para eliminar ("depurar") el sulfuro de hidrógeno de las corrientes de gas. Esta conversión se logra oxidando el sulfuro de hidrógeno a azufre elemental, que no es volátil:
2 [Fe (EDTA)] - + H2S → 2 [Fe (EDTA)] 2− + S + 2 H +
En esta aplicación, el centro de hierro (III) se reduce a su derivado de hierro (II), que luego puede volver a oxidarse con aire. De manera similar, los óxidos de nitrógeno se eliminan de las corrientes de gas con [Fe (edta)] 2−. Las propiedades oxidantes de [Fe (edta)] - también se aprovechan en fotografía, donde se utiliza para disolver partículas de plata.
Se utilizó EDTA en la separación de los metales lantánidos mediante cromatografía de intercambio iónico. Perfeccionado por F. H. Spedding et al.En 1954, el método se basa en el aumento constante de la constante de estabilidad de los complejos de lantánidos EDTA con número atómico. Usando perlas de poliestireno sulfonado y Cu2 + como ión de retención, el EDTA hace que los lantánidos migren a lo largo de la columna de resina a medida que se separan en bandas de lantánidos puros. Los lantánidos eluyen en orden de número atómico decreciente. Debido al costo de este método, en comparación con la extracción a contracorriente, el intercambio iónico ahora solo se usa para obtener la mayor pureza de los lantánidos (generalmente superior al 99,99%).
-Medicamento
Una sal específica de EDTA, conocida como edetato de sodio y calcio, se usa para unir iones metálicos en la práctica de la terapia de quelación, como para el tratamiento del envenenamiento por mercurio y plomo. Se usa de manera similar para eliminar el exceso de hierro del cuerpo. Esta terapia se usa para tratar la complicación de las transfusiones de sangre repetidas, como las que se usarían para tratar la talasemia.
Los dentistas y endodoncistas utilizan soluciones de EDTA para eliminar la suciedad inorgánica (capa de frotis) y lubricar los conductos radiculares en endodoncia. Este procedimiento ayuda a preparar los conductos radiculares para la obturación. Además, con la adición de un surfactante, las soluciones de EDTA aflojan la calcificación en un conducto radicular y permiten la instrumentación (canalización) y facilitan la progresión apical de una lima en un conducto radicular estrecho o calcificado hasta el ápice.
Sirve como conservante (generalmente para mejorar la acción de otro conservante como el cloruro de benzalconio o el tiomersal) en preparaciones para los ojos y gotas para los ojos.
En la evaluación de la función renal, el complejo de cromo (III) [Cr (edta)] - (como cromo-51 radiactivo (51Cr)) se administra por vía intravenosa y se controla su filtración en la orina. Este método es útil para evaluar la tasa de filtración glomerular (TFG) en medicina nuclear.
El EDTA se usa ampliamente en el análisis de sangre. Es un anticoagulante de muestras de sangre para CBC / FBE, donde el EDTA quela el calcio en la muestra de sangre, detiene el proceso de coagulación y mantiene la morfología de las células sanguíneas. Los tubos con EDTA están marcados con cogollos lavanda o rosa. El EDTA también se encuentra en tubos de color canela para pruebas de plomo y se puede usar en tubos de color azul real para pruebas de metales traza.
El EDTA es un dispersante de moco y se ha demostrado que es muy eficaz para reducir el crecimiento bacteriano durante la implantación de lentes intraoculares (LIO).
Medicina alternativa
Algunos médicos alternativos creen que el EDTA actúa como un antioxidante y evita que los radicales libres dañen las paredes de los vasos sanguíneos, reduciendo así la aterosclerosis. Estas ideas no están respaldadas por estudios científicos y parecen contradecir algunos principios actualmente aceptados. La FDA de EE. UU. No lo ha aprobado para el tratamiento de la aterosclerosis.
-Productos cosméticos
En champús, limpiadores y otros productos para el cuidado personal, las sales de EDTA se utilizan como agente secuestrante para mejorar su estabilidad en el aire.
-Aplicaciones de laboratorio
En el laboratorio, el EDTA se usa ampliamente para la captación de iones metálicos: en bioquímica y biología molecular, el agotamiento de iones se usa a menudo para desactivar enzimas dependientes de metales, ya sea como prueba de su reactividad o para suprimir el daño al ADN, proteínas y polisacáridos. El EDTA también actúa como un inhibidor selectivo contra las enzimas hidrolizantes de dNTP (polimerasa Taq, dUTPasa, MutT), arginasa hepática y peroxidasa de rábano picante independientemente de la quelación de iones metálicos. Estos hallazgos instan a reconsiderar el uso de EDTA como eliminador de iones metálicos bioquímicamente inactivo en experimentos enzimáticos. En química analítica, el EDTA se utiliza en valoraciones complexométricas y análisis de dureza del agua o como agente enmascarante para aislar iones metálicos que interferirían con los análisis.
El EDTA tiene muchas aplicaciones especializadas en laboratorios biomédicos como la oftalmología veterinaria como anticollagenasa para prevenir el agravamiento de las úlceras corneales en animales. En el cultivo de tejidos, el EDTA se utiliza como agente quelante que se une al calcio y previene la unión de cadherinas entre las células, evita la acumulación de células que crecen en suspensión líquida o afloja las células adherentes para que pasen. En histopatología, el EDTA se puede utilizar como agente descalcificador, lo que permite cortar secciones con un microtomo una vez desmineralizada la muestra de tejido. También se sabe que el EDTA inhibe una serie de metalopeptidasas; el método de inhibición se produce mediante la quelación del ión metálico necesario para la actividad catalítica. El EDTA también se puede utilizar para probar la biodisponibilidad de metales pesados en sedimentos. Sin embargo, puede afectar la biodisponibilidad de los metales en solución, lo que puede generar preocupaciones sobre sus efectos en el medio ambiente, especialmente dados sus usos y aplicaciones generalizados.