No tiene ningún artículo en su cesta
Histidina
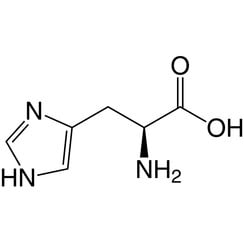
La histidina (símbolo His o H) es un α-aminoácido utilizado en la biosíntesis de proteínas. Contiene un grupo α-amino (que se encuentra en forma protonada –NH3 + en condiciones biológicas), un grupo ácido carboxílico (que está en forma desprotonada –COO en condiciones biológicas) y una cadena lateral de imidazol (que está parcialmente protonada) , lo clasifica como un aminoácido cargado positivamente a pH fisiológico. Inicialmente se pensó que era esencial solo para los bebés, pero ahora los estudios a largo plazo han demostrado que también es esencial para los adultos. Está codificado por los codones CAU y CAC.
La histidina fue aislada por primera vez por el médico alemán Albrecht Kossel y Sven Gustaf Hedin en 1896. También es un precursor de la histamina, un agente inflamatorio esencial en las reacciones inmunes. El radical acilo es histidilo.
El ácido conjugado (forma protonada) de la cadena lateral del imidazol en la histidina tiene un pK de aproximadamente 6,0. Entonces, a un pH de menos de 6, el anillo de imidazol generalmente está protonado (como se describe en la ecuación de Henderson-Hasselbalch). El anillo de imidazolio resultante tiene dos enlaces NH y tiene una carga positiva. La carga positiva se distribuye por igual entre ambos átomos de nitrógeno y puede representarse mediante dos estructuras de resonancia igualmente importantes. Por encima de pH 6, se pierde uno de los dos protones. El protón restante del anillo de imidazol puede estar en nitrógeno, dando lugar a lo que se conoce como tautómeros N1-H o N3-H. El tautómero N3-H, que se muestra en la figura anterior, está protonado en el nitrógeno n. ° 3 más lejos del esqueleto de aminoácidos que lleva los grupos amino y carboxilo, mientras que el tautómero N1-H está protonado en el nitrógeno más cercano al esqueleto. El anillo imidazol / imidazolio de la histidina es aromático en todos los valores de pH.
Las propiedades ácido-básicas de la cadena lateral del imidazol son relevantes para el mecanismo catalítico de muchas enzimas. En las tríadas catalíticas, el nitrógeno basal de la histidina extrae un protón de la serina, treonina o cisteína para activarlo como nucleófilo. En una lanzadera de protones de histidina, la histidina se usa para mover protones rápidamente. Puede hacer esto extrayendo un protón con su nitrógeno básico para hacer un intermedio cargado positivamente y luego usando otra molécula, un tampón, para extraer el protón de su nitrógeno ácido. En las anhidrasas carbónicas, se utiliza una lanzadera de protones de histidina para eliminar rápidamente los protones de una molécula de agua unida a zinc para regenerar rápidamente la forma activa de la enzima. En las hélices de hemoglobina E y F, la histidina afecta la unión de oxígeno y monóxido de carbono. Esta interacción aumenta la afinidad del Fe (II) por el O2, pero desestabiliza la unión del CO, que se une solo 200 veces más fuertemente en la hemoglobina, en comparación con 20.000 veces más fuerte en el hemo libre.
La tautomería y las propiedades ácido-básicas de la cadena lateral del imidazol se caracterizan por espectroscopía de 15 N NMR. Los dos cambios químicos de 14N son comparables (aproximadamente 200 ppm, en relación con el ácido nítrico en la escala sigma, donde un mayor blindaje corresponde a un mayor desplazamiento químico). Las mediciones espectrales de RMN muestran que el desplazamiento químico de N1-H disminuye ligeramente, mientras que el desplazamiento químico de N3-H disminuye significativamente (aproximadamente 190 frente a 145 ppm). Este cambio indica que se prefiere el tautómero N1-H, posiblemente debido a los enlaces de hidrógeno con el amonio adyacente. El blindaje en N3 se reduce significativamente por el efecto paramagnético de segundo orden, que implica una interacción permitida por la simetría entre el par de nitrógeno solitario y los estados excitados π * del anillo aromático. A pH> 9, los cambios químicos de N1 y N3 son aproximadamente de 185 y 170 ppm.