No tiene ningún artículo en su cesta
Amoníaco 25% puro
- Buy 2 and save 5%
- Buy 6 and save 10%
¿Qué es el amoníaco?
Amoniaco o amoniaco cuando se disuelve en agua. es un compuesto químico de nitrógeno e hidrógeno con la fórmula empírica NH3. Es un gas incoloro, soluble en agua y venenoso con un fuerte olor acre que causa lágrimas y es sofocante. El amoníaco es una sustancia anfótera: actúa como base en condiciones de agua. Forma diferentes series de sales: tanto las sales catiónicas de amonio como las amidas, imidas y nitruros aniónicos en los que uno (amida), dos (imidas) o todos (nitruros) protones (iones hidrógeno) han sido reemplazados por iones metálicos.
El amoníaco es uno de los productos químicos más comúnmente producidos y un material básico para la producción de todos los demás compuestos nitrogenados. La mayor parte del amoníaco se procesa en fertilizantes, especialmente urea y sales de amonio. Hasta ahora (2020) se ha producido casi exclusivamente mediante el proceso Haber-Bosch a partir de los elementos hidrógeno y nitrógeno.
Biológicamente, el amoníaco tiene una función importante como intermediario en la formación y descomposición de aminoácidos. Debido a la toxicidad de grandes cantidades de amoníaco, se convierte en urea no tóxica o, por ejemplo, en las aves, en ácido úrico para su excreción en el cuerpo.
Aplicaciones
-Material básico para la producción de todos los demás compuestos nitrogenados producidos industrialmente
Con una participación del 40% en 1995, la urea es el principal compuesto producido a partir del amoníaco, que se utiliza principalmente como fertilizante y para la producción de resinas de urea; La urea se obtiene haciendo reaccionar amoníaco con dióxido de carbono.
Además de la urea, otros fertilizantes nitrogenados también se elaboran a partir de amoníaco. Las más importantes son las sales de amonio, nitrato, fosfato y sulfato de amonio. En total, la participación de fertilizantes en el consumo total de amoníaco en 2003 fue del 83%.
Otra sustancia importante elaborada a partir del amoníaco es el ácido nítrico, que a su vez es la materia prima de muchos otros compuestos. En el proceso de Ostwald, el amoníaco reacciona con el oxígeno en las mallas de platino para formar óxidos de nitrógeno, que reaccionan con el agua para formar ácido nítrico.
-Papel en diversas síntesis orgánicas
Las carboxamidas primarias se pueden obtener a partir de amoníaco y derivados de ácido carboxílico adecuados tales como cloruros o ésteres de ácido carboxílico. Por el contrario, la reacción directa del ácido carboxílico y el amoníaco para formar la amida correspondiente ocurre solo a temperaturas elevadas cuando la sal de amonio previamente formada se descompone. Una reacción técnicamente importante es la del ácido adípico y el amoníaco para formar dinitrilo adípico. Esto se hidrogena más a hexametilendiamina, lo que lo convierte en un intermedio para la fabricación de nailon.
Es posible producir anilina mediante la reacción de fenol y amoníaco en un catalizador de silicato de aluminio. Sin embargo, esta ruta sintética requiere más energía y tiene un rendimiento menor que la síntesis y reducción de nitrobenceno y, por lo tanto, solo se usa de manera limitada cuando el fenol está disponible a bajo costo.
-Aplicaciones especiales
La reacción de amoniaco con ácidos se utiliza en la limpieza de gases de combustión. Es capaz de reaccionar con ácido sulfúrico y ácido nítrico y, por lo tanto, elimina los óxidos de azufre y nitrógeno no deseados y nocivos para el medio ambiente de los gases de combustión.
Debido a su alta entalpía de evaporación específica de 1368 kJ / kg, el amoníaco también se utiliza como refrigerante. Las ventajas son la baja inflamabilidad, la inexistente contribución al efecto invernadero o la destrucción de la capa de ozono y el rango de aplicación de -60 a +100 ° C. La toxicidad del compuesto es perjudicial.
La solución de amoníaco también se usa en ampollas olfativas. El estímulo de olor extremo sirve como una estrategia anti-disociativa, por ejemplo, en el contexto de la terapia conductual dialéctica.
El amoníaco reacciona con el ácido tánico que se encuentra en la madera y la vuelve marrón oscuro dependiendo de la concentración del ácido tánico. La madera de roble se transforma, por ejemplo, con amoniaco o sal amoniacal en roble ahumado de color marrón oscuro. El amoníaco también se usa para colorear en la producción de planos (diazotipos).
También existen sistemas experimentales de pilas de combustible en los que se obtiene el hidrógeno necesario cuando se necesita mediante la división del amoniaco mediante procesos químicos. Otro enfoque que se ha explorado es el uso de amoníaco como un dispositivo de almacenamiento de energía química fácil de manejar, por ejemplo, para almacenar el exceso de electricidad de fuentes de energía renovables fluctuantes (eólica y solar) a largo plazo y a escala industrial, con el fin de cerrar brechas en el suministro de estas energías y utilizar fuentes de energía renovables para la propulsión de vehículos, por ejemplo en motores marinos. Debido a la eficiencia de aproximadamente el 55-60% en la conversión de energía eléctrica en energía química a partir de amoníaco y nuevamente en diesel grande
¿Comprar amoníaco?
¡La tienda de descuento de laboratorio vende amoníaco en diferentes envases y por un precio amigable! Así que pide su amoníaco rápida y fácilmente a través de Laboratoriumdiscounter.nl. ¡Enviado rápido!
Datos técnicos:
Fórmula empírica NH3 + H2O
Masa molar (M) 17.03 + aq g / mol
Densidad 0.91
Punto de ebullición (bp) 37,7 ° C
Punto de fusión (pf) -57,5 ° C
ADR 8 III • WGK 2
No. CAS [1336-21-6]
CE no. 215-647-6 • Nº ONU 2672
Downloads
$$$$$
Declaraciones de peligro
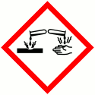
H290 Puede ser corrosivo para los metales.
H314 Provoca quemaduras graves y lesiones oculares graves.
H335 Puede irritar las vías respiratorias.
H400 Muy tóxico para los organismos acuáticos.
Recomendaciones de seguridad
Precauciones: prevención
P273 Evítese su liberación al medio ambiente.
P280 Use guantes de protección / ropa protectora / protección para los ojos / protección facial.
Precauciones - respuesta
P303 + P361 + P353 EN CASO DE CONTACTO CON LA PIEL (o cabello): contaminar inmediatamente la ropa
extraer. Enjuagar la piel con agua [o ducharse].
P305 + P351 + P338 EN CASO DE CONTACTO CON LOS OJOS: Enjuagar cuidadosamente con agua durante un largo período de tiempo.
cantidad de minutos; quítese los lentes de contacto, si es posible; sigue enjuagando.
P310 Llamar inmediatamente a un CENTRO DE TOXICOLOGÍA / médico.