No tiene ningún artículo en su cesta
Piridina 99.75+% Extra pura
- Buy 2 and save 5%
- Buy 6 and save 10%
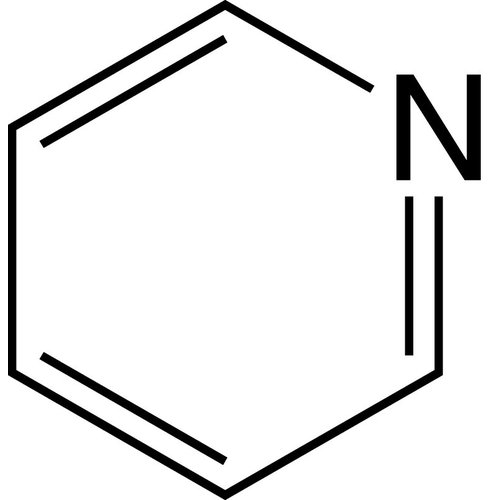
La piridina o azina, con fórmula química C5H5N, es un compuesto heterocíclico simple y básico que se aproxima a la estructura del benceno, con uno de los grupos CH reemplazado por un átomo de nitrógeno. Existe como un líquido claro, ligeramente amarillento con un olor desagradable y acre (ácido, podrido y que recuerda al pescado). Es ampliamente utilizado en química de coordinación como ligando y en química orgánica como reactivo y solvente. Los derivados de piridina son muy numerosos en productos farmacéuticos y agroquímicos. La piridina se utiliza como precursor en la fabricación de insecticidas, herbicidas, medicamentos, saborizantes de alimentos, tintes, adhesivos, pinturas y desinfectantes. Es un compuesto aromático que tiene una reactividad diferente a la del benceno.
La piridina es un líquido en condiciones normales de presión y temperatura. La piridina es miscible con agua y los solventes orgánicos más comunes. La piridina es una molécula de polaridad media, menos polar que el agua y los alcoholes, pero más polar que el acetato de etilo, el diclorometano, el éter de petróleo y los alcanos. En RMN de protones, la piridina aparece bajo tres picos21: 8,5 ppm para el -hidrógeno del nitrógeno, 7,6 ppm para el -hidrógeno y 7,2 ppm en . En la RMN de carbono, la piridina todavía está por debajo de tres picos: a 150 ppm para el carbono 1 y 5, 139 ppm para el carbono 3 y 123 ppm para el carbono 2 y 421. En la espectroscopia infrarroja, la piridina muestra una banda de absorción de unos 3000 cm−1 para el C-H de los carbonos sp222. El umbral de detección olfativa es de 0,02 ppm (en el aire). El índice de refracción es 1.51024. La constante dieléctrica a 25°C es 12.425
La piridina se usa comúnmente como reactivo o catalizador en síntesis orgánica en condensación, deshalogenación, halogenación o acilación y también como precursor para la síntesis de intermediarios utilizados en la fabricación de insecticidas, herbicidas, productos farmacéuticos, saborizantes de alimentos, tintes, adhesivos, pinturas, explosivos y desinfectantes. La piridina se usa luego como precursor de las reacciones de sustitución nucleófila y, más raramente, sustituciones electrofílicas o reacciones de alquilación en nitrógeno. La piridina también se usa para desnaturalizar alcohol, anticongelantes y fungicidas, y también como adyuvante para tintes textiles.
La piridina se usa a menudo como un solvente básico polar y ayuda a neutralizar la formación de ácido en ciertas reacciones. La piridina a menudo se usa como un solvente polar aprótico básico o simplemente se agrega al medio de reacción para neutralizar los ácidos resultantes de estas reacciones. Sin embargo, debido a la alta temperatura de ebullición, a veces es difícil eliminar la piridina y se utilizan otros disolventes orgánicos con una temperatura de ebullición baja.
La d5-piridina deuterada, en la que los átomos de hidrógeno de la piridina han sido reemplazados por átomos de deuterio, se puede utilizar como disolvente en la espectroscopia de RMN.
La piridina y sus derivados pueden usarse para activar ciertas reacciones de acilación o esterificación.
La 4-dimetilaminopiridina (DMAP) se usa para activar los anhídridos durante las reacciones de acilación. El intermedio es una sal de 1-acilpiridio que reacciona con una amina primaria o secundaria para formar una amida.
La 4-(1-pirrolidinil)-piridina (PPY) activa una reacción de esterificación entre un ácido carboxílico y ciertos alcoholes en presencia de DCC (diciclohexilcarbodiimida). PPY reacciona con el intermedio formado por la reacción entre el ácido y DCC, que se comporta de manera similar a un anhídrido de ácido.
La piridina se usa ampliamente como ligando en química de coordinación (en este contexto se abrevia como "py") porque tiene una gran capacidad para formar complejos con muchos cationes de metales de transición. La piridina es un ligando bastante suave en la teoría HSAB. En los complejos, se forma un enlace nitrógeno-metal. Estos complejos se pueden utilizar para análisis selectivos.
Algunos de los complejos de piridina se utilizan para oxidar alcoholes primarios o secundarios.
El reactivo de Collins o Sarret consta de un equivalente de ácido crómico y dos equivalentes de piridina. Se preparan por calentamiento y se diferencian entre sí por su forma cristalina.
El reactivo de Conforth consiste en un equivalente de trióxido de cromo y dos equivalentes de piridina mezclados con agua.
El dicromato de piridinio PDC consiste en un equivalente de dicromato de dos equivalentes de piridina y ácido clorhídrico
El clorocromato de piridinio PCC consta de un equivalente de trióxido de cromo, un equivalente de ácido clorhídrico y piridina.
La piridina, con ácido barbitúrico, se usa a menudo para la detección colorimétrica de cianuros en solución acuosa. Reacciona con el cloruro de cianuro (formado por la reacción entre el ion cianuro y la cloramina-T) para formar una especie conjugada con dos moléculas de ácido barbitúrico, que juntas tienen un tono rojo. La intensidad del color es directamente proporcional a la concentración de cianuro.
Technische gegevens:
Empirical formula C5H5N
Molar mass (M) 79,10 g/mol
Density (D) 0,98
Boiling point (bp) ca. 115 °C
Flash point (flp)17 °C • Melting point (mp)-42 °C
ADR 3 II • WGK 2
CAS No.[110-86-1]
EG-Nr. 203-809-9 • UN-Nr. 1282
Downloads
$$$$$
Hazard statements
H225 Highly flammable liquid and vapor
H302 + H312 + H332 Harmful if swallowed, in contact with skin or if inhaled
H315 Causes skin irritation
H319 Causes serious eye irritation
Precautions - prevention
P210 Keep away from open flames and hot surfaces. Do not smoke.
P233 Keep container tightly closed.
P280 Wear protective gloves / eye protection.
Precautions - response
P302 + P352 IF ON SKIN: Wash with plenty of water.
P304 + P340 IF INHALED: Remove person to fresh air and keep comfortable for breathing.
P305 + P351 + P338 IF IN EYES: Rinse cautiously with water for a long period of time
amount of minutes; remove contact lenses, if possible; keep rinsing.