No tiene ningún artículo en su cesta
Cloruro de aluminio
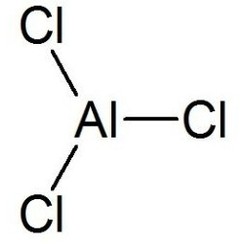
El cloruro de aluminio (AlCl3), también conocido como tricloruro de aluminio, es el principal compuesto de aluminio y cloro. Es de color blanco, pero las muestras suelen estar contaminadas con cloruro de hierro (III), lo que le da un color amarillo. El sólido tiene un punto de fusión y de ebullición bajo. Se produce y consume principalmente en la producción de aluminio metálico, pero también se utilizan grandes cantidades en otras áreas de la industria química. El compuesto se denomina a menudo ácido de Lewis. Es un ejemplo de un compuesto inorgánico que cambia reversiblemente de un polímero a un monómero a temperatura suave.
Aplicaciones
El AlCl3 es probablemente el ácido de Lewis más utilizado y también uno de los más potentes. Encuentra aplicación en la industria química como catalizador de reacciones de Friedel-Crafts, tanto acilaciones como alquilaciones. Los productos importantes son los detergentes y el etilbenceno. También se utiliza en reacciones de polimerización e isomerización de hidrocarburos.
La reacción de Friedel-Crafts es el principal uso del cloruro de aluminio, por ejemplo, en la preparación de antraquinona (para la industria del tinte) a partir de benceno y fosgeno. En la reacción general de Friedel-Crafts, un cloruro de acilo o un haluro de alquilo reacciona con una sustancia aromática.
La reacción de alquilación se usa más ampliamente que la reacción de acilación, aunque la práctica es más exigente técnicamente porque la reacción es más lenta. Para ambas reacciones, el cloruro de aluminio, así como otros materiales y equipos, deben estar secos, aunque se requiere un rastro de humedad para que prosiga la reacción. Un problema común con la reacción de Friedel-Crafts es que el catalizador de cloruro de aluminio a veces se requiere en cantidades estequiométricas completas porque es muy complejo con los productos. Esta complicación a veces produce una gran cantidad de desechos corrosivos. Por estas y otras razones similares, se han buscado catalizadores más reciclables o ecológicos. Por ejemplo, el uso de cloruro de aluminio está siendo reemplazado por zeolitas en algunas aplicaciones.
El cloruro de aluminio también se puede usar para introducir grupos aldehído en anillos aromáticos, por ejemplo mediante la reacción de Gattermann-Koch usando monóxido de carbono, cloruro de hidrógeno y un cocatalizador de cloruro de cobre (I).
El cloruro de aluminio tiene una amplia variedad de otros usos en química orgánica. Por ejemplo, puede catalizar la "reacción eno", como la adición de 3-buten-2-ona (metilvinilcetona) a la carvona.
El AlCl3 también se usa ampliamente para reacciones de polimerización e isomerización de hidrocarburos. Ejemplos importantes son la producción de etilbenceno, que se utilizaba para fabricar estireno y, por tanto, poliestireno, y también la producción de dodecilbenceno, que se utiliza para fabricar detergentes.
El cloruro de aluminio combinado con aluminio en presencia de un areno puede usarse para sintetizar complejos de bis (areno) metálicos, p. bis (benceno) cromo, de ciertos haluros metálicos a través de la llamada síntesis de Fischer-Hafner.
Cloruros de aluminio hidratados
El dihidrato tiene pocos usos, pero el clorhidrato de aluminio es un ingrediente común en los antitranspirantes en concentraciones bajas. Los pacientes con hiperhidrosis requieren una concentración mucho más alta (12% o más), que se vende con marcas como Driclor.