No tiene ningún artículo en su cesta
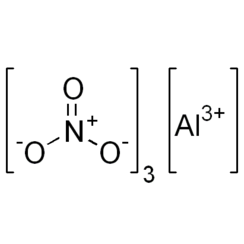
Nitrato de aluminio no hidratado
El nitrato de aluminio es una sal blanca soluble en agua de aluminio y ácido nítrico, que se encuentra más comúnmente como hidrato cristalino, nitrato de aluminio no hidratado, Al (NO3) 3 9H2O.
El nitrato de aluminio no se puede sintetizar mediante la reacción del aluminio con ácido nítrico concentrado porque el aluminio forma una capa de pasivación.
En cambio, el nitrato de aluminio se puede preparar mediante la reacción de ácido nítrico con cloruro de aluminio (III). El cloruro de nitrosilo se produce como subproducto; burbujea de la solución como un gas. La sal se puede facilitar haciendo reaccionar ácido nítrico con hidróxido de aluminio.
El nitrato de aluminio también se puede preparar mediante una reacción de metátesis entre sulfato de aluminio y una sal de nitrato con un catión adecuado como bario, estroncio, calcio, plata o plomo. p.ej. Al2 (SO4) 3 + 3 Ba (NO3) 2 → 2 Al (NO3) 3 + 3 BaSO4.
El nitrato de aluminio es un fuerte agente oxidante. Se utiliza en el curtido de cueros, antitranspirantes, inhibidores de corrosión, extracción de uranio, refinación de petróleo y como agente nitrurante.
Los nitratos de aluminio no hidratados y otros hidratados tienen muchos usos. Estas sales se utilizan para producir óxido de aluminio para la preparación de papel aislante, en elementos calefactores de tubos de rayos catódicos y en laminados de núcleos de transformadores. Las sales hidratadas también se utilizan para la extracción de elementos actínidos.
Se utiliza en el laboratorio y en el aula, como en la reacción.
Al (NO3) 3 + 3 NaOH → Al (OH) 3 + 3 NaNO3
Sin embargo, es mucho menos común que el cloruro de aluminio y el sulfato de aluminio.