Il n'y a aucun article dans votre panier
Ammoniac 25%, pur
- Buy 2 and save 5%
- Buy 6 and save 10%
Qu'est-ce que l'ammoniaque ?
Ammoniac ou ammoniaque dissous dans l'eau. est un composé chimique de l'azote et de l'hydrogène avec la formule empirique NH3. C'est un gaz incolore, soluble dans l'eau et toxique avec une forte odeur piquante qui provoque des larmes et suffoque. L'ammoniac est une substance amphotère: elle agit comme une base dans des conditions aqueuses. Il forme différentes séries de sels: tant les sels cationiques d'ammonium que les amides, imides et nitrures anioniques dans lesquels un (amide), deux (imides) ou tous (nitrures) protons (ions hydrogène) ont été remplacés par des ions métalliques.
L'ammoniac est l'un des produits chimiques les plus couramment produits et un matériau de base pour la production de tous les autres composés azotés. La plupart de l'ammoniac est transformé en engrais, en particulier en sels d'urée et d'ammonium. Jusqu'à présent (2020), il a été presque exclusivement produit en utilisant le procédé Haber-Bosch à partir des éléments hydrogène et azote.
Biologiquement, l'ammoniac a une fonction importante en tant qu'intermédiaire dans la formation et la dégradation des acides aminés. En raison de la toxicité de plus grandes quantités d'ammoniac, il est converti en urée non toxique ou, par exemple chez les oiseaux, en acide urique pour l'excrétion dans le corps.
Applications
-Matériau de base pour la production de tous les autres composés azotés produits industriellement
Avec une part de 40% en 1995, l'urée est le principal composé produit à partir de l'ammoniac, qui est principalement utilisé comme engrais et pour la production de résines d'urée; L'urée est obtenue en faisant réagir l'ammoniaque avec du dioxyde de carbone.
En plus de l'urée, d'autres engrais azotés sont également fabriqués à partir d'ammoniac. Les plus importants sont les sels d'ammonium nitrate, phosphate et sulfate d'ammonium. Au total, la part des engrais dans la consommation totale d'ammoniac en 2003 était de 83%.
Une autre substance importante à base d'ammoniac est l'acide nitrique, qui à son tour est la matière de départ de nombreux autres composés. Dans le processus d'Ostwald, l'ammoniac réagit avec l'oxygène sur les mailles de platine pour former des oxydes d'azote, qui réagissent avec l'eau pour former de l'acide nitrique.
-Rôle dans diverses synthèses organiques
Les carboxamides primaires peuvent être obtenus à partir d'ammoniac et de dérivés d'acide carboxylique appropriés tels que les chlorures ou esters d'acide carboxylique. Au contraire, la réaction directe de l'acide carboxylique et de l'ammoniac pour former l'amide correspondant ne se produit qu'à des températures élevées lorsque le sel d'ammonium formé précédemment se décompose. Une réaction techniquement importante est celle de l'acide adipique et de l'ammoniac pour former du dinitrile adipique. Celui-ci est ensuite hydrogéné en hexaméthylènediamine, ce qui en fait un intermédiaire pour la fabrication de nylon.
Il est possible de produire de l'aniline par réaction du phénol et de l'ammoniac sur un catalyseur au silicate d'aluminium. Cependant, cette voie de synthèse nécessite plus d'énergie et a un rendement inférieur à la synthèse et à la réduction du nitrobenzène et n'est donc utilisée que dans une mesure limitée lorsque le phénol est disponible à bas prix.
-Applications spéciales
La réaction de l'ammoniac avec les acides est utilisée dans l'épuration des gaz de combustion. Il est capable de réagir avec l'acide sulfurique et l'acide nitrique et élimine ainsi les oxydes de soufre et d'azote indésirables et nocifs pour l'environnement des gaz de combustion.
En raison de son enthalpie d'évaporation spécifique élevée de 1368 kJ / kg, l'ammoniac est également utilisé comme réfrigérant. Les avantages sont une faible inflammabilité, la contribution inexistante à l'effet de serre ou à la destruction de la couche d'ozone et le domaine d'application de -60 à +100 ° C. La toxicité du composé est néfaste.
La solution d'ammoniaque est également utilisée dans les ampoules olfactives. Le stimulus d'odeur extrême sert de stratégie anti-dissociative, par exemple dans le contexte de la thérapie comportementale dialectique.
L'ammoniac réagit avec l'acide tannique présent dans le bois et le fait brunir foncé en fonction de la concentration de l'acide tannique. Le bois de chêne est transformé, par exemple, avec de l'ammoniaque ou du sel ammoniac en chêne fumé brun foncé. L'ammoniac est également utilisé pour la coloration dans la production de plans (diazotypes).
Il existe également des systèmes expérimentaux de piles à combustible dans lesquels l'hydrogène nécessaire est obtenu lorsque cela est nécessaire en divisant l'ammoniac à l'aide de procédés chimiques. Une autre approche qui a été explorée consiste à utiliser l'ammoniac comme un dispositif de stockage d'énergie chimique facile à manipuler, par exemple pour stocker l'excès d'électricité provenant de sources d'énergie renouvelables fluctuantes (éolienne et solaire) à long terme et à l'échelle industrielle, combler les lacunes dans l'approvisionnement de ces énergies et utiliser des sources d'énergie renouvelables pour la propulsion des véhicules, par exemple dans les moteurs marins. En raison de l'efficacité d'environ 55 à 60% dans la conversion de l'énergie électrique en énergie chimique à partir de l'ammoniac et de nouveau en gros diesel
Acheter de l'ammoniaque ?
Le discounter de laboratoire vend de l'ammoniac dans différents conditionnements et à un prix d'ami ! Ainsi, vous commandez votre ammoniac rapidement et facilement via Laboratoriumdiscounter.nl. Expédié rapidement !
Données techniques:
Formule empirique NH3 + H2O
Masse molaire (M) 17,03 + aq g / mol
Densité 0,91
Point d'ébullition (bp) 37,7 ° C
Point de fusion (mp) -57,5 ° C
ADR 8 III • WGK 2
No CAS [1336-21-6]
CE no. 215-647-6 • N ° ONU 2672
Downloads
$$$$$
Mentions de danger
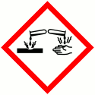
H290 Peut être corrosif pour les métaux
H314 Provoque des brûlures et des lésions oculaires graves
H335 Peut irriter les voies respiratoires
H400 Très toxique pour la vie aquatique
Recommandations de sécurité
Précautions - prévention
P273 Éviter le rejet dans l'environnement.
P280 Porter des gants de protection / des vêtements de protection / un équipement de protection des yeux / du visage.
Précautions - réponse
P303 + P361 + P353 EN CAS DE CONTACT AVEC LA PEAU (ou les cheveux): contaminer immédiatement les vêtements
extraire. Rincer la peau à l'eau [ou se doucher].
P305 + P351 + P338 EN CAS DE CONTACT AVEC LES YEUX: rincer avec précaution à l'eau pendant une longue période
nombre de minutes; retirer les lentilles de contact, si possible; continuez à rincer.
P310 Appeler immédiatement un CENTRE ANTIPOISON / un médecin.