Il n'y a aucun article dans votre panier
Acide aspartique
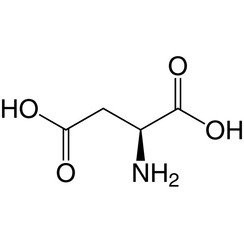
L'acide aspartique (symbole Asp ou D; sa forme ionique est appelée aspartate), est un acide α-aminé utilisé dans la biosynthèse des protéines. Comme tous les acides aminés, il contient un groupe amino et un acide carboxylique. Le groupe α-amino est situé dans le protoné -NH +
3 se forme dans des conditions physiologiques, tandis que son groupe acide α-carboxylique est déprotoné -COO- dans des conditions physiologiques. L'acide aspartique a une chaîne latérale acide (CH2COOH) qui réagit avec d'autres acides aminés, enzymes et protéines du corps. Dans des conditions physiologiques (pH 7,4) dans les protéines, la chaîne latérale se présente généralement sous la forme d'aspartate chargée négativement, -COO -. [5] C'est un acide aminé non essentiel chez l'homme, ce qui signifie que le corps peut le synthétiser au besoin. Il est codé par les codons GAU et GAC.
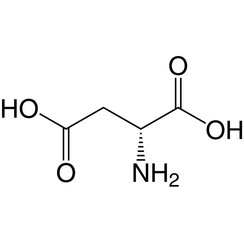
Le D-aspartate est l'un des deux acides aminés D que l'on trouve couramment chez les mammifères.
Dans les protéines, les chaînes latérales d'aspartate sont souvent liées à l'hydrogène pour former des spires asx ou des motifs asx, qui se produisent souvent aux N terminaux des hélices alpha.
L'isomère L d'Asp est l'un des 22 acides aminés protéinogènes, c'est-à-dire les éléments constitutifs des protéines. L'acide aspartique, comme l'acide glutamique, est classé comme un acide aminé acide, avec un pKa de 3,9, mais dans un peptide, il dépend fortement de l'environnement local et peut atteindre 14. Asp est omniprésent dans la biosynthèse. Puisque l'aspartate peut être produit par le corps, il est classé comme un acide aminé non essentiel.