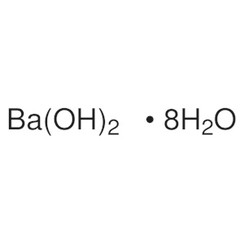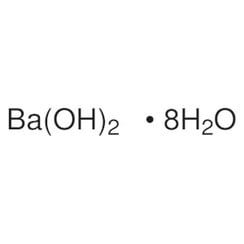Il n'y a aucun article dans votre panier
Hydroxyde de baryum
L'hydroxyde de baryum est un composé chimique de formule chimique Ba (OH) 2 (H2O) x. Le monohydrate (x = 1), connu sous le nom d'eau de barytine ou de barytine, est l'un des composés les plus importants du baryum. Ce monohydrate granulaire blanc est la forme commerciale habituelle.
Applications
Industriellement, l'hydroxyde de baryum est utilisé comme précurseur d'autres composés du baryum. Le monohydrate est utilisé pour déshydrater et éliminer le sulfate de divers produits. Cette application profite de la très faible solubilité du sulfate de baryum. Cette application industrielle est également appliquée aux applications de laboratoire.
-Utilisation en laboratoire
L'hydroxyde de baryum est utilisé en chimie analytique pour le titrage des acides faibles, en particulier des acides organiques. La solution aqueuse limpide est garantie sans carbonate, contrairement à celle de l'hydroxyde de sodium et de l'hydroxyde de potassium, car le carbonate de baryum est insoluble dans l'eau. Cela permet d'utiliser des indicateurs comme la phénolphtaléine ou la thymolphtaléine (avec des changements de couleur alcaline) sans risque d'erreurs de titrage dues à la présence d'ions carbonates, qui sont beaucoup moins basiques.
L'hydroxyde de baryum est parfois utilisé en synthèse organique comme base forte, par exemple pour l'hydrolyse d'esters et de nitriles et comme base dans les condensations d'aldol.
Il a été utilisé pour hydrolyser l'un des deux groupes ester équivalents dans l'hendécanedioate de diméthyle.
L'hydroxyde de baryum est également utilisé dans la décarboxylation des acides aminés qui libèrent du carbonate de baryum.
Il est également utilisé dans la préparation de cyclopentanone, d'alcool diacétonique et de D-Gulonic γ-lactone.
L'hydroxyde de baryum se décompose en oxyde de baryum lorsqu'il est chauffé à 800 ° C. La réaction avec le dioxyde de carbone donne du carbonate de baryum. La solution aqueuse, fortement alcaline, subit des réactions de neutralisation avec des acides. Ainsi, il forme respectivement du sulfate de baryum et du phosphate de baryum avec l'acide sulfurique et l'acide phosphorique. La réaction avec le sulfure d'hydrogène produit du sulfure de baryum. La précipitation de nombreux sels de baryum insolubles ou moins solubles peut résulter d'une double réaction de remplacement lorsqu'une solution aqueuse d'hydroxyde de baryum est mélangée avec de nombreuses solutions d'autres sels métalliques.
Les réactions de l'hydroxyde de baryum avec les sels d'ammonium sont hautement endothermiques. La réaction de l'hydroxyde de baryum octahydraté avec du chlorure d'ammonium ou du thiocyanate d'ammonium est souvent utilisée comme démonstration en classe, produisant des températures suffisamment froides pour geler l'eau et suffisamment d'eau pour dissoudre le mélange résultant.