Il n'y a aucun article dans votre panier
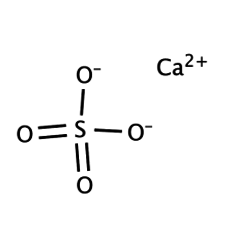
Sulfate de calcium
Le sulfate de calcium est le composé inorganique de formule CaSO4 et les hydrates associés. Sous forme de γ-anhydrite (la forme anhydre), il est utilisé comme agent de séchage. Un hydrate est plus communément appelé gypse et un autre se produit naturellement sous le nom de gypse minéral. Il a de nombreuses utilisations dans l'industrie. Toutes les formes sont des solides blancs qui sont peu solubles dans l'eau. Le sulfate de calcium provoque une dureté permanente de l'eau.
Applications
L'utilisation principale du sulfate de calcium est la production de plâtre et de stuc. Ces utilisations tirent parti du fait que le sulfate de calcium en poudre et calciné forme une pâte moulable lors de l'hydratation et durcit sous forme de sulfate de calcium cristallin dihydraté. Il est également pratique que le sulfate de calcium soit peu soluble dans l'eau et ne se dissolve pas facilement au contact de l'eau après la solidification.
-Réactions d'hydratation et de déshydratation
Avec un chauffage doux, le gypse est transformé en un minéral partiellement déshydraté appelé gypse ou gypse de Paris. Ce matériau a la formule CaSO4 (nH2O), où 0,5 ≤ n ≤ 0,8. Des températures comprises entre 100 et 150 ° C (212–302 ° F) sont nécessaires pour expulser l'eau à l'intérieur de sa structure. Les détails de la température et du temps dépendent de l'humidité. Des températures allant jusqu'à 170 ° C (338 ° F) sont utilisées dans la calcination industrielle, mais à ces températures, la y-anhydrite commence à se former. L'énergie thermique fournie au gypse à ce stade (la chaleur de l'hydratation) a tendance à chasser l'eau (sous forme de vapeur d'eau) au lieu d'augmenter la température du minéral, qui augmente lentement jusqu'à ce que l'eau disparaisse. puis augmente plus rapidement. L'équation de la déshydratation partielle est:
CaSO4 2 H2O → CaSO4 1/2 H2O + 1 + 1/2 H2O ↑
La propriété endothermique de cette réaction est pertinente pour la performance des cloisons sèches, conférant une résistance au feu aux structures résidentielles et autres. Lors d'un incendie, la structure derrière une plaque de plâtre reste relativement froide car de l'eau est perdue du plâtre, empêchant (ou retardant considérablement) les dommages à la moulure (par la combustion de pièces de bois ou la perte de résistance de l'acier à des températures élevées). et par conséquent l'effondrement structurel. Mais à des températures plus élevées, le sulfate de calcium libère de l'oxygène et agit comme un agent oxydant. Cette propriété est utilisée dans l'énergie thermique de l'aluminium. Contrairement à la plupart des minéraux, qui forment facilement des pâtes liquides ou semi-liquides ou restent poudreux une fois réhydraté, le gypse calciné a une propriété inhabituelle: lorsqu'il est mélangé avec de l'eau à des températures normales (ambiantes), il revient rapidement chimiquement à la forme dihydratée souhaitée. , tout en "ajustant" physiquement pour former un réseau cristallin de gypse rigide et relativement solide:
CaSO4 1/2 H2O + 1 + 1/2 H2O → CaSO4 2 H2O
Cette réaction est exothermique et est responsable de la facilité avec laquelle le plâtre peut être coulé dans une variété de formes, y compris des feuilles (pour cloisons sèches), des bâtons (pour la craie pour tableau noir) et des moules (pour immobiliser les os cassés ou pour la coulée de métal). Mélangé à des polymères, il a été utilisé comme ciment de réparation osseuse. De petites quantités de gypse calciné sont ajoutées au sol pour créer des structures solides directement à partir du sol coulé, une alternative à l'adobe (qui perd sa résistance lorsqu'il est mouillé). Les conditions de déshydratation peuvent être modifiées pour ajuster la porosité de l'hémihydrate, résultant en ce que l'on appelle les hémihydrates α et β (qui sont plus ou moins chimiquement identiques).
Lorsqu'elle est chauffée à 180 ° C (356 ° F), la forme presque anhydre appelée γ-anhydrite (CaSO4 nH2O où n = 0 à 0,05) est produite. Le γ-anhydrite réagit lentement avec l'eau pour revenir à l'état dihydraté, une propriété exploitée dans certains dessicants commerciaux. Lorsqu'elle est chauffée au-dessus de 250 ° C, il se forme la forme complètement anhydre qui est appelée β-anhydrite ou anhydrite «naturelle». L'anhydrite naturelle ne réagit pas avec l'eau, même à des échelles de temps géologiques, sauf si elle est très finement broyée.
La composition variable de l'hémihydrate et du y-anhydrite, et leur interconversion facile, est due à leurs structures cristallines presque identiques contenant des «canaux» qui peuvent absorber des quantités variables d'eau, ou d'autres petites molécules comme le méthanol.
-Industrie alimentaire
Les hydrates de sulfate de calcium sont utilisés comme coagulant dans des produits tels que le tofu.
La FDA l'autorise dans le fromage et les produits fromagers connexes; Farine de céréales; Produits de boulangerie; Desserts glacés; Édulcorants artificiels pour gelées et conserves; Légumes condiments; et condimenter des tomates et des bonbons.
Il est connu dans la série de numéros E comme E516 et la FAO le connaît comme un agent raffermissant, un agent de traitement de la farine, un agent séquestrant et un agent de levée.
-Autres utilisations
Lorsqu'il est vendu à l'état anhydre comme déshydratant avec un indicateur de couleur appelé Drierite, il apparaît bleu (anhydre) ou rose (hydraté) par imprégnation avec du chlorure de cobalt (II), qui agit comme un indicateur d'humidité.
Jusque dans les années 1970, des quantités commerciales d'acide sulfurique étaient produites à partir de sulfate de calcium anhydre à Whitehaven (Cumbria, Royaume-Uni). Lorsqu'il est mélangé avec du schiste ou de la marne et torréfié, le sulfate libère du trioxyde de soufre, un précurseur dans la production d'acide sulfurique, la réaction produit également du silicate de calcium, une phase minérale essentielle dans la production de clinker de ciment.