Il n'y a aucun article dans votre panier
Acide gallique
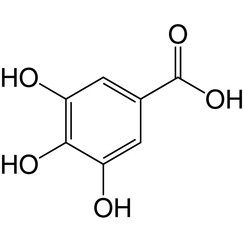
L'acide gallique (également connu sous le nom d'acide 3,4,5-trihydroxybenzoïque) est un acide trihydroxybenzoïque, un type d'acide phénolique, présent dans les noix de galle, le sumac, l'hamamélis, les feuilles de thé, l'écorce de chêne et d'autres plantes. La formule chimique de l'acide gallique est C6H2 (OH) 3COOH. On le trouve seul ou dans le cadre de tanins hydrolysables. Les groupes d'acide gallique sont généralement liés à des dimères tels que l'acide ellagique. Les tanins hydrolysables s'hydrolysent pour donner de l'acide gallique et du glucose ou de l'acide ellagique et du glucose, appelés respectivement gallotanins et ellagitanins.
L'acide gallique forme des esters intermoléculaires (depsides) tels que les acides digallique et trigallique et les esters d'éther cycliques (depsidones).
L'acide gallique est largement utilisé dans l'industrie pharmaceutique comme étalon pour déterminer la teneur en phénol de divers analytes par le test Folin-Ciocalteau; les résultats sont exprimés en équivalents d'acide gallique. L'acide gallique peut également être utilisé comme matière de départ dans la synthèse de l'alcaloïde psychédélique mescaline.
Le nom est dérivé des galles de chêne, qui étaient traditionnellement utilisées pour préparer de l'acide tannique. Malgré son nom, l'acide gallique ne contient pas de gallium. Les sels et esters de l'acide gallique sont appelés "gallates".
-Contexte historique et usages
L'acide gallique est une partie importante de l'encre de galate de fer, l'encre d'écriture et de dessin européenne standard du XIIe au XIXe siècle, avec une histoire remontant à l'Empire romain et aux manuscrits de la mer Morte. Pline l'Ancien (23-79 après JC) décrit l'utilisation de l'acide gallique comme moyen de détecter un faux vert-de-gris et écrit qu'il était utilisé pour produire des colorants. Les galles (également appelées pommes de chêne) des chênes ont été broyées et mélangées à de l'eau, produisant de l'acide tannique. Il peut ensuite être mélangé avec du vitriol vert (sulfate ferreux) - obtenu par évaporation de l'eau saturée en sulfate d'un puits ou d'un drainage minier - et de la gomme d'acacia d'acacia; cette combinaison d'ingrédients a produit l'encre.
L'acide gallique était l'une des substances utilisées par Angelo Mai (1782–1854), parmi d'autres chercheurs du palimpseste, pour enlever la couche supérieure du texte et révéler les manuscrits cachés en dessous. Mai a été le premier à l'utiliser, mais l'a fait «d'une main lourde», endommageant souvent des manuscrits pour une étude ultérieure par d'autres chercheurs.
L'acide gallique a été étudié pour la première fois en 1786 par le chimiste suédois Carl Wilhelm Scheele. En 1818, le chimiste et pharmacien français Henri Braconnot (1780–1855) a inventé une méthode plus simple pour purifier l'acide gallique des galles; l'acide gallique a également été étudié par le chimiste français Théophile-Jules Pelouze (1807–1867).
L'acide gallique est un composant de certains mélanges pyrotechniques pour flûtes.
-Recherche
C'est un faible inhibiteur de l'anhydrase carbonique. Une étude a montré que l'acide gallique a un effet sur la formation de protéines amyloïdes en modifiant les propriétés de l'alpha-synucléine, une protéine associée au développement de maladies neurodégénératives.
- Évitez bien sûr
L'acide gallique se trouve dans un certain nombre de plantes terrestres, telles que la plante parasite Cynomorium coccineum, la plante aquatique Myriophyllum spicatum et l'algue bleu-vert Microcystis aeruginosa. L'acide gallique est également présent dans plusieurs espèces de chênes, Caesalpinia mimosoides et dans l'écorce de tige de Boswellia dalzielii. De nombreux aliments contiennent des quantités variables d'acide gallique, en particulier des fruits (y compris des fraises, des raisins, des bananes), du thé, des clous de girofle et du vinaigre. Le fruit de la caroube est une riche source d'acide gallique (24-165 mg pour 100 g).
-Production
L'acide gallique est facilement libéré des galotanins par hydrolyse acide ou alcaline. Lorsque l'acide gallique est chauffé avec de l'acide sulfurique concentré, le rufigallol est produit par condensation. L'oxydation avec de l'acide arsénique, du permanganate, du persulfate ou de l'iode donne de l'acide ellagique, tout comme la réaction du gallate de méthyle avec le chlorure de fer (III).