Il n'y a aucun article dans votre panier
Acide maléique
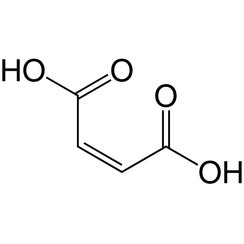
L'acide maléique ou acide cis-butènedioïque est un composé organique qui est un acide dicarboxylique, une molécule à deux groupes carboxyle. Sa formule chimique est HO2CCH = CHCO2H. L'acide maléique est l'isomère cis de l'acide butènedioïque tandis que l'acide fumarique est l'isomère trans. Il est principalement utilisé comme précurseur de l'acide fumarique, et comparé à l'anhydride maléique d'origine, l'acide maléique a peu d'utilisations.
Fabrication et applications industrielles
Dans l'industrie, l'acide maléique est obtenu par hydrolyse de l'anhydride maléique, ce dernier étant produit par oxydation du benzène ou du butane.
L'acide maléique est une matière première industrielle pour la production d'acide glyoxylique par ozonolyse.
L'acide maléique peut être utilisé pour former des sels d'addition d'acide avec des médicaments pour les rendre plus stables, comme le maléate d'indacatérol.
L'acide maléique est également utilisé comme promoteur d'adhésion pour divers substrats, tels que le nylon et les métaux revêtus de zinc, par exemple l'acier galvanisé, dans les adhésifs à base de méthacrylate de méthyle.
Isomérisation en acide fumarique
La principale utilisation industrielle de l'acide maléique est sa conversion en acide fumarique. Cette conversion, une isomérisation, est catalysée par une variété de réactifs, tels que les acides minéraux et la thiourée. Encore une fois, la grande différence de solubilité dans l'eau facilite la purification de l'acide fumarique.
L'isomérisation est un sujet populaire dans les écoles. L'acide maléique et l'acide fumarique ne s'échangent pas spontanément car la rotation autour d'une double liaison carbone-carbone n'est pas énergétiquement favorable. Cependant, la conversion de l'isomère cis en isomère trans est possible par photolyse en présence d'une petite quantité de brome. La lumière convertit le brome élémentaire en un radical brome, qui attaque l'oléfine lors de l'addition de radicaux à un radical bromo-alcane; et maintenant la rotation d'une liaison simple est possible. Les radicaux brome se recombinent et de l'acide fumarique se forme. Dans une autre méthode (utilisée comme démonstration en classe), l'acide maléique est converti en acide fumarique en chauffant l'acide maléique dans une solution d'acide chlorhydrique. L'addition réversible (de H +) conduit à une rotation libre autour de la liaison centrale C-C et à la formation de l'acide fumarique plus stable et moins soluble.
Certaines bactéries produisent l'enzyme maléate isomérase, qui est utilisée par les bactéries dans le métabolisme du nicotinate. Cette enzyme catalyse l'isomérisation entre le fumarate et le maléate.