Il n'y a aucun article dans votre panier
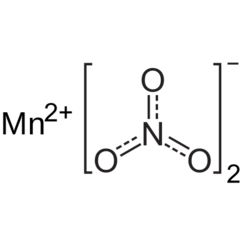
Nitrate de manganèse (II)
Le nitrate de manganèse (II) sont les composés inorganiques de formule Mn (NO3) 2 (H2O) n. Chaque unité de formule se compose d'un cation Mn2 + et de deux anions NO3 et de différentes quantités d'eau. Le plus courant est le tétrahydrate Mn (NO3) 2 · 4H2O, mais les mono et hexahydrates sont également connus sous le nom de composé anhydre. Certains de ces composés sont des précurseurs utiles des oxydes de manganèse.
Préparation, réactions, applications
Le nitrate de manganèse (II) est préparé en dissolvant l'oxyde de manganèse (II) dans de l'acide nitrique:
MnO + 2 HNO3 → Mn (NO3) 2 + H2O
Il peut également être préparé à partir de dioxyde de manganèse et de dioxyde d'azote:
MnO2 + 2 NO2 → Mn (NO3) 2
Lorsqu'elles sont chauffées à 300 ° C, les solutions aqueuses de nitrate de manganèse (II) se décomposent thermiquement pour former MnO2 et NO2.
Le nitrate de manganèse (II) est le précurseur du carbonate de manganèse, qui est utilisé dans les engrais et comme colorant. L'avantage de cette méthode, utilisant de l'ammoniac et du dioxyde de carbone, est que le sous-produit nitrate d'ammonium est également utile comme engrais.