Il n'y a aucun article dans votre panier
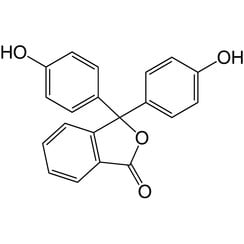
Phénolphtaléine
La phénolphtaléine est un composé chimique de formule C20H14O4 et est brièvement écrite comme "HIn" ou "phph". La phénolphtaléine est souvent utilisée comme indicateur dans les titrages acido-basiques. Pour cette application, il devient incolore dans les solutions acides et rose dans les solutions basiques. Il appartient à la classe des colorants appelés colorants phtaléine.
La phénolphtaléine est peu soluble dans l'eau et est généralement dissoute dans les alcools pour être utilisée dans les expériences. C'est un acide faible qui peut perdre des ions H + en solution. La molécule de phénolphtaléine est incolore et l'ion phénolphtaléine est rose. Lorsqu'une base est ajoutée à la phénolphtaléine, l'équilibre se déplace, ce qui entraîne une plus grande ionisation lorsque les ions H + sont éliminés. Ceci est prédit par le principe de Le Chatelier.
Applications
indicateur de pH
L'utilisation répandue de la phénolphtaléine est un indicateur des titrages acido-basiques. Il sert également de composant d'indicateur universel, avec le rouge de méthyle, le bleu de thymol et le thymol.
La phénolphtaléine suppose au moins quatre états différents en solution aqueuse en raison des changements de pH. Dans des conditions très acides, il existe sous forme protonée (HIn +), ce qui lui donne une couleur orange. Entre des conditions fortement acides et légèrement basiques, la forme lactone (HIn) est incolore. La forme phénolate double déprotoné (In2) (la forme anionique du phénol) donne la couleur rose familière. Dans les solutions hautement basiques, la phénolphtaléine est convertie en sa forme In (OH) 3 et la couleur rose subit une réaction de décoloration assez lente et devient complètement incolore au-dessus de 13,0 pH.
-Carbonatation du béton
La sensibilité au pH de la phénolphtaléine est exploitée dans d'autres applications: le béton a naturellement un pH élevé en raison de l'hydroxyde de calcium formé lorsque le ciment Portland réagit avec l'eau. Lorsque le béton réagit avec le dioxyde de carbone dans l'atmosphère, le pH tombe à 8,5-9. Lorsqu'une solution de phénolphtaléine à 1% est appliquée sur du béton normal, elle devient rose vif. Cependant, s'il reste incolore, cela montre que le béton a subi une carbonatation. Dans une application similaire, certains revêtements utilisés pour réparer les trous dans les cloisons sèches contiennent de la phénolphtaléine. Lors de l'application, le matériau de base de l'emballage conserve une couleur rose; lorsque le revêtement est durci par réaction avec le dioxyde de carbone atmosphérique, la couleur rose s'estompe.
-Éducatif
Dans une solution très basique, le lent changement de la phénolphtaléine de rose à incolore lorsqu'elle est convertie en sa forme In (OH) 3 est utilisé dans les cours de chimie pour l'étude de la cinétique de réaction.
-Divertissement
La phénolphtaléine est utilisée dans les jouets, comme dans le cadre de la disparition de l'encre ou de la peinture sur les cheveux de Hollywood Hair Barbie. Dans l'encre, il est mélangé avec de l'hydroxyde de sodium, qui réagit avec le dioxyde de carbone dans l'air. Cette réaction fait chuter le pH en dessous du seuil de changement de couleur lorsque des ions hydrogène sont libérés de la réaction:
OH− (aq) + CO2 (g) → CO2−
3 (aq) + H + (aq).
Pour développer les cheveux et les motifs graphiques «magiques», l'encre est pulvérisée avec une solution d'hydroxyde, ce qui conduit à l'apparition des images cachées par le même mécanisme décrit ci-dessus pour le changement de couleur en solution alcaline. En raison de la réaction avec le dioxyde de carbone, le motif disparaît finalement. La thymolphtaléine est utilisée dans le même but et de la même manière lorsqu'une couleur bleue est souhaitée.
-Utilisation médicale
La phénolphtaléine est utilisée comme laxatif depuis plus d'un siècle, mais elle est maintenant retirée des laxatifs en vente libre en raison de problèmes de cancérogénicité. Les produits laxatifs qui contenaient auparavant de la phénolphtaléine ont souvent été reformulés avec des ingrédients actifs alternatifs: Feen-a-Mint est passé au bisacodyl et Ex-Lax est passé à un extrait de séné.
La thymolphtaléine est un laxatif apparenté à base de thymol.
Malgré les inquiétudes quant à sa cancérogénicité, l'utilisation de la phénolphtaléine comme laxatif est peu susceptible de provoquer un cancer de l'ovaire. Il a été démontré que la phénolphtaléine inhibe l'afflux de calcium cellulaire humain via l'entrée de calcium en magasin (SOCE, voir Activation du canal de libération du calcium § Structure). Ceci est accompli par la thrombine inhibitrice et la thapsigargine, deux activateurs de SOCE qui augmentent le calcium libre intracellulaire.
La phénolphtaléine a été ajoutée à la liste candidate de l'Agence européenne des produits chimiques pour les substances extrêmement préoccupantes (SVHC). [14]
Une forme réduite de phénolphtaléine, la phénolphtaline, qui est incolore, est utilisée dans un test pour identifier des substances censées contenir du sang, communément appelé test de Kastle-Meyer. Un échantillon sec est collecté avec un coton-tige ou du papier filtre. Quelques gouttes d'alcool, puis quelques gouttes de phénolphtaline et enfin quelques gouttes de peroxyde d'hydrogène coulaient sur l'échantillon. Si l'échantillon contient de l'hémoglobine, il devient immédiatement rose lors de l'ajout du peroxyde en raison de la formation de phénolphtaléine. Un test positif indique que l'échantillon contient de l'hémoglobine et est donc probablement du sang. Un faux positif peut être dû à la présence de substances ayant une activité catalytique similaire à l'hémoglobine. Ce test n'est pas destructeur pour l'échantillon; il peut être enregistré et utilisé dans d'autres tests. Ce test a la même réaction avec le sang de tout animal dont le sang contient de l'hémoglobine, y compris presque tous les vertébrés; des tests supplémentaires seraient nécessaires pour déterminer s'il s'agissait d'un humain.
La phénolphtaléine peut être fabriquée en condensant l'anhydride phtalique avec deux équivalents de phénol dans des conditions acides (d'où le nom). Il a été découvert en 1871 par Adolf von Baeyer.
La réaction peut également être catalysée par un m