Il n'y a aucun article dans votre panier
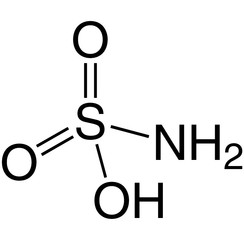
Acide sulfamique
L'acide sulfamique, également connu sous le nom d'acide amidosulfonique, est un composé moléculaire de formule H3NSO3. Ce composé incolore et soluble dans l'eau a de nombreuses utilisations. L'acide sulfamique fond à 205 ° C et se décompose à des températures plus élevées en eau, trioxyde de soufre, dioxyde de soufre et azote.
L'acide sulfamique (H3NSO3) peut être considéré comme un composé intermédiaire entre l'acide sulfurique (H2SO4) et le sulfamide (H4N2SO2), remplaçant efficacement un groupe hydroxyle (–OH) par un groupe amine (–NH2) à chaque étape. Ce modèle ne peut pas s'étendre davantage dans les deux sens sans décomposer le résidu sulfonyle (–SO2–). Les sulfamates sont des dérivés de l'acide sulfamique.
Applications
L'acide sulfamique est avant tout un précurseur de composés au goût sucré. La réaction avec la cyclohexylamine suivie de l'addition de NaOH donne C6H11NHSO3Na, cyclamate de sodium. Les composés apparentés sont également des édulcorants, tels que l'acésulfame-k.
Les sulfamates ont été utilisés dans la conception de nombreux types d'agents thérapeutiques tels que les antibiotiques, les inhibiteurs nucléosidiques / nucléotidiques de la transcriptase inverse du virus de l'immunodéficience humaine (VIH), les inhibiteurs de la protéase du VIH (IP), les médicaments anticancéreux (stéroïdes sulfatase et inhibiteurs de l'anhydrase carbonique), les antiépileptiques et les agents de perte de poids.
-Agent de nettoyage
L'acide sulfamique est utilisé comme agent de nettoyage acide, parfois pur ou dans le cadre de mélanges exclusifs, généralement pour les métaux et les céramiques. Il est souvent utilisé pour éliminer la rouille et le tartre, en remplaçant l'acide chlorhydrique plus volatil et irritant, qui est moins cher. C'est souvent un composant d'agents détartrants ménagers, par exemple le gel épais Lime-A-Way contient jusqu'à 8% d'acide sulfamique et a un pH de 2,0 à 2,2, ou des détergents utilisés pour l'élimination du calcaire. Comparé aux acides minéraux forts les plus courants, l'acide sulfamique a des propriétés de décalcification de l'eau souhaitables, une faible volatilité et une faible toxicité. Il forme des sels hydrosolubles de calcium et de fer.
Pour sa sécurité intrinsèque, l'acide sulfamique est préféré à l'acide chlorhydrique. S'il est mal mélangé avec des produits à base d'hypochlorite tels que l'eau de Javel, il ne formera pas de chlore gazeux, contrairement à la plupart des acides courants; la réaction (neutralisation) avec de l'ammoniac donne un sel.
Il trouve également des applications dans le nettoyage industriel des équipements laitiers et de brasserie. Bien que considérés comme moins corrosifs que l'acide chlorhydrique, des inhibiteurs de corrosion sont souvent ajoutés aux nettoyants commerciaux dont il est un composant. Il peut être utilisé pour détartrer les machines à café et expresso domestiques et dans les nettoyants dentaires.
-Autres utilisations
Catalyseur pour le processus d'estérification
Fabrication de colorants et pigments
Herbicide
Coagulateur pour résines urée-formaldéhyde
Ingrédient dans les moyens d'extinction d'incendie. L'acide sulfamique est la principale matière première du sulfamate d'ammonium, un herbicide largement utilisé et un matériau ignifuge pour
produits menagers.
Industrie des pâtes et papiers comme stabilisant du chlorure
La forme déprotonée (sulfamate) est un contre-ion courant pour le nickel (II) en galvanoplastie.
Utilisé pour séparer les ions nitrite d'un mélange d'ions nitrite et nitrate (NO3− + NO2−) lors de l'analyse qualitative du nitrate à l'aide d'un test Brown Ring.
-Polissage argent
Selon l'étiquette sur le produit de consommation, le produit de nettoyage d'argent liquide TarnX contient de la thiourée, un détergent et de l'acide sulfamique.