Il n'y a aucun article dans votre panier
Acide tartrique
L'acide tartrique est un acide organique cristallin blanc qui se trouve naturellement dans de nombreux fruits, en particulier les raisins, mais aussi les bananes, les tamarins et les agrumes. Le sel, le bitartrate de potassium, communément appelé crème tartre, se développe naturellement lors de la vinification. Il est souvent mélangé avec du bicarbonate de sodium et vendu sous forme de levure chimique utilisée comme agent levant dans la préparation des aliments. L'acide lui-même est ajouté aux aliments en tant qu'antioxydant E334 et lui donne son goût aigre distinctif.
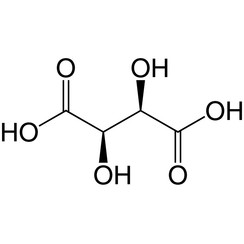
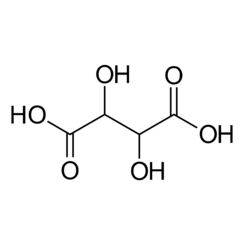
L'acide tartrique est un acide alpha-hydroxycarboxylique, est l'acide diprotique et aldaarique dans les caractéristiques acides et est un dérivé dihydroxyle de l'acide succinique.
L'acide tartrique naturel est chiral et est une matière première utile pour la synthèse chimique organique. La forme naturelle de l'acide est l'acide dextrotartrique ou acide L - (+) - tartrique (nom obsolète acide d-tartrique). Comme il est naturellement disponible, il est légèrement moins cher que son énantiomère et son isomère méso. Les préfixes dextro et levo sont des termes archaïques. Les manuels modernes désignent la forme naturelle comme l'acide tartrique (2R, 3R) (acide L - (+) - tartrique) et son énantiomère comme l'acide tartrique (2S, 3S) (acide D - (-) - tartrique). Le méso diastéréoisomère est l'acide (2R, 3S) tartrique (qui est identique à "l'acide (2S, 3R) tartrique").
Alors que les deux stéréoisomères chiraux font tourner la lumière polarisée plane dans des directions opposées, les solutions d'acide méso-tartrique ne font pas tourner la lumière polarisée plate. L'absence d'activité optique est due à un plan miroir dans la molécule [ligne segmentée dans l'image ci-dessous]
L'acide tartrique dans la solution de Fehling se lie aux ions cuivre (II), empêchant la formation de sels d'hydroxyde insolubles.
L'acide tartrique et ses dérivés ont une pléthore d'utilisations dans le domaine pharmaceutique. Par exemple, il est utilisé dans la production de sels effervescents, en combinaison avec de l'acide citrique, pour améliorer le goût des médicaments oraux. Le dérivé de potassium antimonyle de l'acide connu sous le nom de tartre émétique est inclus à petites doses dans le sirop contre la toux comme expectorant.
L'acide tartrique a également plusieurs utilisations industrielles. Il a été observé que l'acide chélate des ions métalliques tels que le calcium et le magnésium. Par conséquent, l'acide a servi dans l'agriculture et l'industrie métallurgique comme agent chélatant pour complexer les micronutriments dans les engrais du sol et pour nettoyer les surfaces métalliques contenant respectivement de l'aluminium, du cuivre, du fer et des alliages de ces métaux.