Il n'y a aucun article dans votre panier
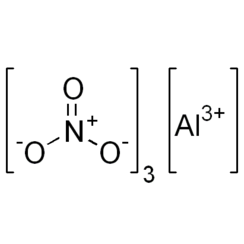
Nitrate d'aluminium nonahydraté
Le nitrate d'aluminium est un sel blanc, soluble dans l'eau, d'aluminium et d'acide nitrique, le plus souvent sous forme d'hydrate cristallin, le nitrate d'aluminium nonahydraté, Al (NO3) 3 9H2O.
Le nitrate d'aluminium ne peut pas être synthétisé par la réaction de l'aluminium avec de l'acide nitrique concentré car l'aluminium forme une couche de passivation.
Le nitrate d'aluminium peut à la place être préparé par réaction d'acide nitrique avec du chlorure d'aluminium (III). Le chlorure de nitrosyle est produit comme sous-produit; il bouillonne hors de la solution comme un gaz. Le sel peut être rendu plus facile en faisant réagir l'acide nitrique avec de l'hydroxyde d'aluminium.
Le nitrate d'aluminium peut également être préparé par une réaction de métathèse entre le sulfate d'aluminium et un sel de nitrate avec un cation approprié tel que le baryum, le strontium, le calcium, l'argent ou le plomb. par exemple. Al2 (SO4) 3 + 3 Ba (NO3) 2 → 2 Al (NO3) 3 + 3 BaSO4.
Le nitrate d'aluminium est un agent oxydant puissant. Il est utilisé dans le tannage du cuir, les anti-transpirants, les inhibiteurs de corrosion, l'extraction de l'uranium, le raffinage du pétrole et comme agent de nitruration.
Les nitrates d'aluminium nonahydratés et hydratés ont de nombreuses utilisations. Ces sels sont utilisés pour produire de l'oxyde d'aluminium pour la préparation de papier isolant, dans des éléments chauffants de tubes cathodiques et sur des stratifiés de noyau de transformateur. Les sels hydratés sont également utilisés pour l'extraction d'éléments actinides.
Il est utilisé en laboratoire et en classe, comme dans la réaction
Al (NO3) 3 + 3 NaOH → Al (OH) 3 + 3 NaNO3
Cependant, il est beaucoup moins courant que le chlorure d'aluminium et le sulfate d'aluminium.