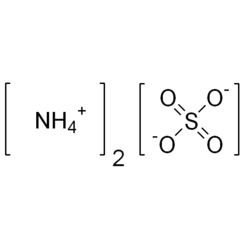Il n'y a aucun article dans votre panier
Sulfate d'ammonium
Le sulfate d'ammonium (NH4) 2SO4 est un sel inorganique avec un certain nombre d'utilisations commerciales. Son utilisation la plus courante est comme engrais pour le sol. Il contient 21% d'azote et 24% de soufre.
Utilisation
Le sulfate d'ammonium est principalement utilisé comme engrais pour les sols alcalins. Dans le sol, l'ion ammonium est libéré et forme une petite quantité d'acide, abaissant l'équilibre du pH du sol et contribuant à l'azote essentiel à la croissance des plantes. Le principal inconvénient de l'utilisation du sulfate d'ammonium est la faible teneur en azote par rapport au nitrate d'ammonium, ce qui augmente les coûts de transport.
Il est également utilisé comme adjuvant de pulvérisation agricole pour les insecticides, herbicides et fongicides solubles dans l'eau. Là, il fonctionne pour lier les cations de fer et de calcium qui sont présents dans l'eau de source et les cellules végétales. Il est particulièrement efficace comme adjuvant aux herbicides 2,4-D (amine), glyphosate et glufosinate.
-Utilisation en laboratoire
La précipitation au sulfate d'ammonium est une méthode couramment utilisée de purification des protéines par précipitation. Lorsque la force ionique d'une solution augmente, la solubilité des protéines dans cette solution diminue. En raison de sa nature ionique, le sulfate d'ammonium est très soluble dans l'eau et peut donc "précipiter" les protéines par précipitation. En raison de la constante diélectrique élevée de l'eau, les ions sel dissociés, à savoir l'ammonium cationique et le sulfate anionique, sont facilement solubles dans les enveloppes d'hydratation des molécules d'eau. L'importance de cette substance dans la purification des composés découle de sa capacité à devenir plus hydratée par rapport à des molécules relativement plus non polaires et donc les molécules non polaires souhaitées fusionnent et précipitent sous forme concentrée à partir de la solution. . Cette méthode est appelée relargage et nécessite l'utilisation de concentrations élevées de sel qui peuvent se dissoudre de manière fiable dans le mélange aqueux. Le pourcentage de sel utilisé est comparé à la concentration maximale du sel dans le mélange qui peut se dissoudre. En tant que tel, bien que des concentrations élevées soient nécessaires pour que le procédé fonctionne, l'ajout d'une abondance de sel, supérieure à 100%, peut également rendre la solution sursaturée, contaminant le précipité non polaire avec un précipité de sel. Une concentration élevée en sel, qui peut être obtenue en ajoutant ou en augmentant la concentration de sulfate d'ammonium dans une solution, permet une séparation des protéines basée sur une diminution de la solubilité des protéines; cette séparation peut être réalisée par centrifugation. La précipitation au sulfate d'ammonium résulte d'une solubilité réduite plutôt que d'une dénaturation des protéines, de sorte que la protéine précipitée peut être dissoute en utilisant des tampons standards. La précipitation au sulfate d'ammonium constitue un moyen pratique et simple de fractionner des mélanges complexes de protéines.
Dans l'analyse des grilles en caoutchouc, les acides gras volatils sont analysés en précipitant le caoutchouc avec une solution de sulfate d'ammonium à 35%, ce qui laisse un liquide clair à partir duquel les acides gras volatils sont régénérés avec de l'acide sulfurique, puis distillés à la vapeur. La précipitation sélective avec du sulfate d'ammonium, contrairement à la technique de précipitation conventionnelle utilisant l'acide acétique, n'affecte pas la détermination des acides gras volatils.
-Additif alimentaire
En tant qu'additif alimentaire, le sulfate d'ammonium est considéré comme généralement sûr (GRAS) par la Food and Drug Administration des États-Unis et désigné dans l'Union européenne par le numéro E E517. Il est utilisé comme régulateur d'acidité dans la farine et le pain.
-Autres utilisations
Dans le traitement de l'eau potable, le sulfate d'ammonium est utilisé en combinaison avec du chlore pour générer de la monochloramine pour la désinfection.
Le sulfate d'ammonium est utilisé à petite échelle dans la préparation d'autres sels d'ammonium, en particulier le persulfate d'ammonium.
Le sulfate d'ammonium est répertorié comme ingrédient dans de nombreux vaccins américains selon le Center for Disease Control.
Une solution saturée de sulfate d'ammonium dans de l'eau lourde (D2O) est utilisée comme étalon externe dans la spectroscopie RMN du soufre (33S) avec une valeur de décalage de 0 ppm.
Le sulfate d'ammonium a également été utilisé dans des compositions ignifuges qui agissent fortement sur le phosphate de diammonium. En tant qu'ignifuge, il augmente la température de combustion du matériau, diminue les taux de perte de poids maximum et provoque une augmentation de la production de résidus ou de charbon. Le caractère ignifuge peut être amélioré en le mélangeant avec du sulfamate d'ammonium. Il a été utilisé dans la lutte aérienne contre les incendies.
Le sulfate d'ammonium a été utilisé comme agent de préservation du bois, mais en raison de sa nature hygroscopique, cette utilisation a été en grande partie interrompue en raison des problèmes associés à la corrosion des fixations métalliques, à l'instabilité dimensionnelle et aux échecs de finition.