Il n'y a aucun article dans votre panier
Sulfate d'ammonium et de fer (II)
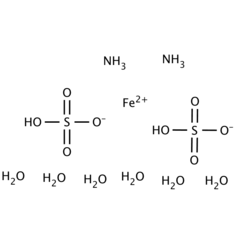
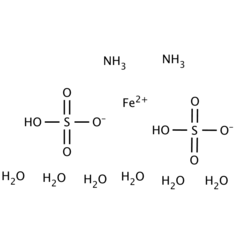
Le sulfate d'ammonium et de fer (II) ou sel de Mohr est le composé inorganique de formule (NH4) 2Fe (SO4) 2 (H2O) 6. Il contient deux cations différents, Fe2 + et NH4 +, et est classé comme un sel double de sulfate ferreux et de sulfate d'ammonium. C'est un réactif de laboratoire courant car il cristallise facilement et les cristaux résistent à l'oxydation par l'air. Comme les autres sels de sulfate ferreux, le sulfate d'ammonium ferreux se dissout dans l'eau pour obtenir l'aquocomplexe [Fe (H2O) 6] 2+, qui a une géométrie moléculaire octaédrique. La forme minérale est la mohrite.
En chimie analytique, ce sel est la source préférée d'ions ferreux car le solide a une longue durée de conservation et résiste à l'oxydation. Cette stabilité s'étend quelque peu aux solutions qui reflètent l'effet du pH sur le couple redox ferreux / ferrique. Cette oxydation se produit plus facilement à pH élevé. Les ions ammonium rendent les solutions de sel de Mohr légèrement acides, ce qui ralentit ce processus d'oxydation. L'acide sulfurique est souvent ajouté aux solutions pour réduire l'oxydation en fer.
Il est utilisé dans le dosimètre Fricke pour mesurer des doses élevées de rayonnement gamma.