Il n'y a aucun article dans votre panier
1,4-Dithiothréitol (DTT)
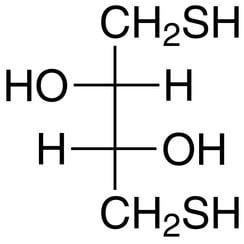
Le dithiothréitol (DTT) est le nom commun d'un réactif redox à petite molécule, également connu sous le nom de réactif de Cleland. La formule du dithiothréitol est C4H10O2S2 et la structure chimique de l'un de ses énantiomères sous forme réduite est indiquée sur la droite; la forme oxydée est un cycle à 6 chaînons à liaison disulfure. Le réactif est souvent utilisé sous sa forme racémique car les deux énantiomères sont réactifs. Son nom est dérivé du quadruple sucre, le thréose. La TNT a une connexion épimérique (`` sœur ''), le dithioérythritol (DTE)
Le DTT est utilisé comme agent réducteur ou agent "déprotecteur" pour l'ADN thiolé. Les atomes de soufre terminaux de l'ADN thiolé ont tendance à former des dimères en solution, en particulier en présence d'oxygène. La dimérisation diminue considérablement l'efficacité des réactions de couplage ultérieures telles que l'immobilisation de l'ADN sur l'or dans les biocapteurs. Typiquement, le dithiothréitol est mélangé avec une solution d'ADN, puis éliminé par filtration (pour le catalyseur solide) ou par chromatographie (pour la forme liquide). La procédure d'élimination du DTT est souvent appelée "dessalage". En général, le DTT est utilisé comme agent protecteur qui empêche l'oxydation des groupes thiol.
Le DTT est souvent utilisé pour réduire les liaisons disulfure des protéines et, plus généralement, pour empêcher la formation de liaisons disulfure intramoléculaires et intermoléculaires entre les résidus cystéine des protéines. Mais même le DTT ne peut pas réduire les liaisons disulfure enterrées (inaccessibles aux solvants), de sorte que la réduction des liaisons disulfure est parfois effectuée dans des conditions de dénaturation (par exemple, à des températures élevées ou en présence d'un dénaturant fort tel que le chlorure de guanidinium 6 M, l'urée 8 M ou le dodécyl sulfate de sodium 1%) . Le DTT est souvent utilisé en conjonction avec le dodécyl sulfate de sodium dans SDS-PAGE pour dénaturer davantage les protéines en réduisant leurs liaisons disulfure afin de permettre une meilleure séparation des protéines pendant l'électrophorèse. En raison de sa capacité à réduire les liaisons disulfure, le DTT peut être utilisé pour dénaturer le CD38 sur les globules rouges. Inversement, l'exposition des différentes liaisons disulfure au solvant peut être déterminée par leur taux de déclin en présence de DTT.
Le DTT peut également être utilisé comme agent oxydant. Le principal avantage est qu'il n'y a en fait aucune espèce de disulfure mixte peuplée, contrairement à d'autres agents tels que le glutathion. Dans de très rares cas, un adduit de DTT peut être formé, c'est-à-dire que les deux atomes de soufre du DTT peuvent former des liaisons disulfure avec différents atomes de soufre; dans de tels cas, le DTT ne peut pas se cycliser car il ne contient pas de tels thiols libres résiduels