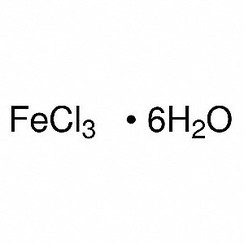Il n'y a aucun article dans votre panier
Chlorure ferrique
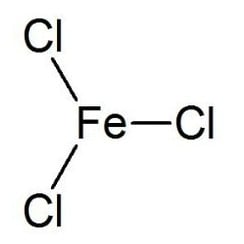
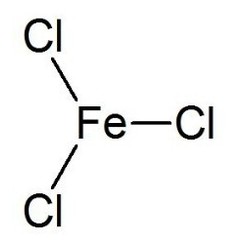
Le chlorure de fer (III) est le composé inorganique de formule (FeCl3). Aussi appelé chlorure ferrique, c'est un composé commun du fer à l'état d'oxydation +3. Le composé anhydre est un solide cristallin avec un point de fusion de 307,6 ° C. La couleur dépend de l'angle de vue: les cristaux apparaissent vert foncé en lumière réfléchie, mais apparaissent rouge violacé en lumière transmise.
Structure et propriétés
-Anhydre
Le chlorure de fer anhydre (III) a la structure BiI3, avec des centres octaédriques Fe (III) interconnectés par des ligands de chlore avec deux coordonnées.
Le chlorure de fer (III) a un point de fusion relativement bas et bout autour de 315 ° C. concurrence avec la décomposition réversible pour donner du chlorure de fer (II) et du chlore gazeux.
-Hydrate
En plus du matériau anhydre, le chlorure ferrique forme quatre hydrates. Toutes les formes de chlorure de fer (III) contiennent deux chlorures ou plus comme ligands et trois hydrates contiennent du FeCl4 -.
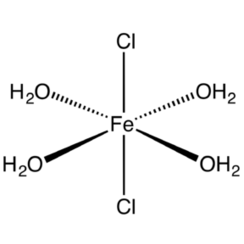
hexahydraté: FeCl3.6H2O a la formule développée trans- [Fe (H2O) 4Cl2] Cl.2H2O
FeCl3.2.5H2O a la formule structurelle cis- [Fe (H2O) 4Cl2] [FeCl4] .H2O.
dihydraté: FeCl3.2H2O a la formule développée trans- [Fe (H2O) 4Cl2] [FeCl4].
FeCl3.3.5H2O a la formule développée cis- [FeCl2 (H2O) 4] [FeCl4] .3H2O.
-Solution aqueuse
Les solutions aqueuses de chlorure ferrique sont généralement jaunes, contrairement aux solutions rose pâle de [Fe (H2O) 6] 3+. D'après les mesures spectroscopiques, les espèces les plus importantes dans les solutions aqueuses de chlorure ferrique sont le complexe octaédrique [FeCl2 (H2O) 4] + (stéréochimie non spécifiée) et le tétraèdre [FeCl4] -.
Applications
-Industriel
Le chlorure de fer (III) est utilisé dans le traitement des eaux usées et dans la production d'eau potable comme coagulant et floculant. Dans cette application, dans l'eau légèrement basique, le chlorure ferrique réagit avec l'ion hydroxyde pour former un flocon d'hydroxyde de fer (III), ou plus précisément formulé en FeO (OH) -, qui peut éliminer les matières en suspension.
Il est également utilisé comme agent de lixiviation en hydrométallurgie des chlorures, par exemple dans la production de Si à partir de FeSi (procédé Silgrain).
Une autre application importante du chlorure de fer (III) est la gravure du cuivre dans une réaction redox en deux étapes sur le chlorure de cuivre (I) puis sur le chlorure de cuivre (II) dans la production de cartes de circuits imprimés
Le chlorure de fer (III) est utilisé comme catalyseur pour la réaction de l'éthylène avec le chlore pour former du dichlorure d'éthylène (1,2-dichloroéthane), un produit chimique important principalement utilisé dans la production industrielle de chlorure de vinyle, le monomère pour la fabrication du PVC.
-Utilisation en laboratoire
En laboratoire, le chlorure de fer (III) est souvent utilisé comme acide de Lewis pour catalyser des réactions telles que la chloration de composés aromatiques et la réaction de Friedel-Crafts des aromatiques. Il est moins puissant que le chlorure d'aluminium, mais dans certains cas, cette douceur conduit à des rendements plus élevés, par exemple dans l'alkylation du benzène
Le test au chlorure ferrique est un test colorimétrique traditionnel pour les phénols, utilisant une solution de chlorure de fer (III) à 1% neutralisée avec de l'hydroxyde de sodium jusqu'à ce qu'une légère précipitation de FeO (OH) se forme. Le mélange est filtré avant utilisation. La matière organique est dissoute dans l'eau, le méthanol ou l'éthanol, puis la solution de chlorure de fer (III) neutralisée est ajoutée - une décoloration transitoire ou permanente (généralement violette, verte ou bleue) indique la présence d'un phénol ou d'un énol.
Cette réaction est exploitée dans le test ponctuel Trinder, qui est utilisé pour indiquer la présence de salicylates, en particulier d'acide salicylique, qui contient un groupe OH phénolique.
Ce test peut être utilisé pour détecter la présence d'acide gamma-hydroxybutyrique et de gamma-butyrolactone, la faisant virer au brun rougeâtre.
Autres utilisations
-Utilisé anhydre comme réactif de séchage dans certaines réactions.
-Utilisé pour détecter la présence de composés phénoliques en synthèse organique; examiner, par exemple, la pureté de l'aspirine synthétisée.
-Utilisé dans le traitement de l'eau et des eaux usées pour précipiter le phosphate sous forme de phosphate de fer (III).
-Utilisé dans le traitement des eaux usées pour le contrôle des odeurs.
-Utilisé par les collectionneurs américains pour identifier les dates des piquets Buffalo qui sont tellement usés que la date n'est plus visible.
Utilisé par les forgerons de lames et les artisans du soudage de modèles pour graver le métal, lui donnant un effet de contraste, pour visualiser les couches métalliques ou les imperfections.
-Utilisé pour graver le motif widmanstatten dans les météorites de fer.
-Nécessaire pour graver des plaques en taille-douce pour l'impression photographique et visuelle