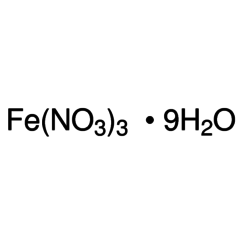Il n'y a aucun article dans votre panier
Nitrate de fer (III)
Le nitrate de fer (III) ou nitrate ferrique est le composé chimique de formule Fe (NO3) 3.
Propriétés chimiques
Décomposition
Après dissolution, le nitrate de fer (III) forme une solution jaune à la suite de l'hydrolyse. Lorsqu'il est chauffé à ébullition proche, l'acide nitrique s'évapore de la solution et tout le fer précipitera sous forme d'oxyde de fer (III) Fe2O3.
Le composé se dissout dans l'acide stéarique fondu et se décompose à environ 120 ° C en hydroxyde d'oxyde de fer (III) FeO (OH).
Préparation
Le composé peut être préparé en traitant la poudre de fer métallique avec de l'acide nitrique.
Fe + 4 HNO3 → Fe (NO3) 3 + NO + 2 H2O.
Applications
-Dans le laboratoire
Le nitrate de fer (II) est le catalyseur de choix pour la synthèse de l'amidure de sodium à partir d'une solution de sodium dans l'ammoniac:
2 NH3 + 2 Na → 2 NaNH2 + H2
Certaines argiles imprégnées de nitrate ferrique se sont révélées être des agents oxydants utiles en synthèse organique. Par exemple, le nitrate ferrique sur la montmorillonite - un réactif appelé "Clayfen" - a été utilisé pour l'oxydation d'alcools en aldéhydes et de thiols en disulfures.
-Autres applications
Les bijoutiers et les forgerons utilisent des solutions de nitrate de fer pour graver l'argent et les alliages d'argent.