Il n'y a aucun article dans votre panier
Lysine
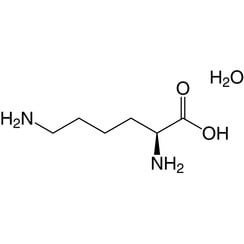
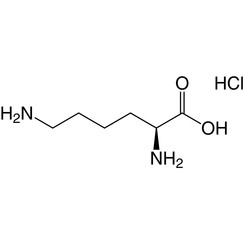
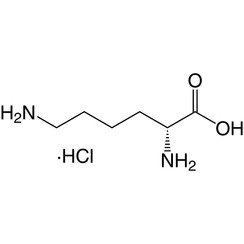
La lysine (symbole Lys ou K) est un acide α-aminé utilisé dans la biosynthèse des protéines. Il contient un groupe α-amino (qui est sous la forme protonée -NH3 + dans des conditions biologiques), un groupe acide α-carboxylique (qui est sous la forme -COO déprotonée dans des conditions biologiques) et une chaîne latérale lysyle ((CH2 4NH2), le classe comme un acide aminé aliphatique basique chargé (à pH physiologique). Il est codé par les codons AAA et AAG. Comme presque tous les autres acides aminés, le carbone a est chiral et la lysine peut désigner un énantiomère ou un mélange racémique des deux. Aux fins de cet article, la lysine fait référence à l'énantiomère biologiquement actif L-lysine, où le carbone alpha est dans la configuration S.
Le corps humain ne peut pas synthétiser la lysine. Il est essentiel chez l'homme et doit être obtenu par l'alimentation. Dans les organismes synthétisant la lysine, elle possède deux voies de biosynthèse majeures, les voies du diaminopimélate et de l'α-aminoadipate, qui utilisent des enzymes et des substrats différents et se retrouvent dans différents organismes. Le catabolisme de la lysine se déroule selon l'une des voies, la plus courante étant la voie de la saccharopine.
La lysine joue divers rôles chez l'homme, notamment la protéinogenèse, mais aussi dans la réticulation des polypeptides de collagène, l'absorption de nutriments minéraux essentiels et dans la production de carnitine, qui est essentielle au métabolisme des acides gras. La lysine est également souvent impliquée dans les modifications des histones et affecte ainsi l'épigénome. Le groupe e-amino participe souvent à la liaison hydrogène et comme base générale de la catalyse. Le groupe e-ammonium (NH3 +) est attaché au quatrième carbone du carbone α, qui est attaché au groupe carboxyle (C = OOH).
En raison de son importance dans divers processus biologiques, une carence en lysine peut entraîner divers états pathologiques, notamment un tissu conjonctif défectueux, une altération du métabolisme des acides gras, une anémie et un déficit énergétique systémique des protéines. En revanche, une abondance de lysine causée par un catabolisme inefficace peut provoquer de graves troubles neurologiques.
La lysine a été isolée pour la première fois par le chimiste biologique allemand Ferdinand Heinrich Edmund Drechsel en 1889 à partir de la caséine protéique du lait. Il l'a appelé «lysine». En 1902, les chimistes allemands Emil Fischer et Fritz Weigert déterminent la structure chimique de la lysine en la synthétisant.