Il n'y a aucun article dans votre panier
Acétate de magnésium
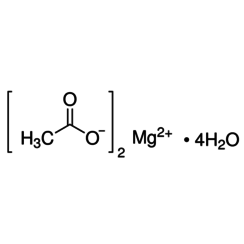
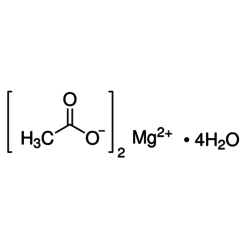
L'acétate de magnésium a la formule chimique Mg (C2H3O2) 2 et sous sa forme hydratée, l'acétate de magnésium tétrahydraté, il a la formule chimique Mg (CH3COO) 2 • 4H2O. Dans ce composé, le magnésium a un état d'oxydation de 2+. L'acétate de magnésium est le sel de magnésium de l'acide acétique. Il est déliquescent et lorsqu'il est chauffé, il se décompose en oxyde de magnésium. L'acétate de magnésium est souvent utilisé comme source de magnésium dans les réactions biologiques.
Utilisations et applications
En 1881, Charles Clamond a inventé le Clamond Basket, l'un des premiers manchons à gaz efficaces. Les réactifs utilisés dans cette invention comprennent l'acétate de magnésium, l'hydroxyde de magnésium et l'eau.
L'acétate de magnésium est souvent utilisé comme source de magnésium ou pour l'ion acétate dans les expériences chimiques. Par exemple, l'acétate de magnésium et le nitrate de magnésium ont tous deux été utilisés pour effectuer des simulations de dynamique moléculaire et des mesures de tension superficielle. Dans l'expérience, les auteurs ont constaté que l'acétate avait une plus forte affinité pour la surface que l'ion nitrate et que le Mg2 + se repoussait fortement de l'interférence air / liquide. Ils ont également constaté que le Mg2 + avait une plus forte tendance à se lier à l'ion acétate par rapport au nitrate.
L'une des utilisations les plus courantes de l'acétate de magnésium est le mélange appelé acétate de calcium et de magnésium (CMA). C'est un mélange d'acétate de calcium et d'acétate de magnésium. Le CMA est considéré comme une alternative écologique au fer pour le NaCl et le CaCl2. Le CMA agit également comme un moyen puissant de contrôler le SO2, les NOx et les particules toxiques dans les processus de combustion du charbon pour réduire les pluies acides, et comme un catalyseur efficace pour faciliter la combustion du charbon.
Il a été démontré que l'acétate de magnésium provoque un changement de conformation de l'enzyme Primase d'Escherichia coli. Dans cette expérience, Mg (OAc) 2, MnCl2, CaCl2, NaOAc, LiCl, MgSO4 et MgCl2 ont tous été comparés pour voir quel effet ils avaient sur l'enzyme Primase d'Escherichia coli. Les chercheurs ont découvert que Mg (OAc) 2 était le meilleur changement conformationnel. MgSO4 et MgCl2 ont causé l'effet dans une certaine mesure, tandis que les autres ne l'ont pas fait.
Lorsqu'il est mélangé avec du peroxyde d'hydrogène, l'acétate de magnésium agit comme un agent bactéricide.
L'acétate de magnésium s'est avéré efficace pour incinérer des composés organiques en préparation d'une analyse du fluor lorsque des concentrations élevées ou faibles de fluor sont présentes.