Il n'y a aucun article dans votre panier
Peroxyde d'hydrogène
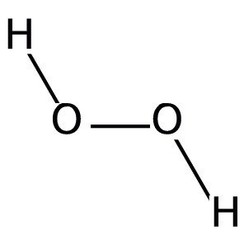
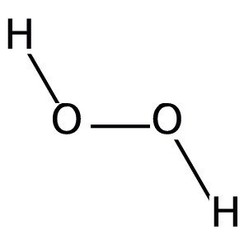
Le peroxyde d'hydrogène est un composé chimique de formule H2O2. Dans sa forme pure, c'est un liquide bleu clair, légèrement plus visqueux que l'eau. Le peroxyde d'hydrogène est le peroxyde le plus simple (un composé avec une liaison simple oxygène-oxygène). Il est utilisé comme oxydant, javellisant et antiseptique. Le peroxyde d'hydrogène concentré, ou «peroxyde de test élevé», est une espèce oxygénée réactive et a été utilisé comme propulseur dans les fusées. La chimie est dominée par la nature de la liaison peroxyde instable.
Le peroxyde d'hydrogène est instable et se décompose lentement en présence de lumière. En raison de son instabilité, le peroxyde d'hydrogène est généralement stocké avec un stabilisant dans une solution faiblement acide dans une bouteille de couleur sombre. Le peroxyde d'hydrogène se trouve dans les systèmes biologiques, y compris le corps humain. Les enzymes qui utilisent ou décomposent le peroxyde d'hydrogène sont classées comme des peroxydases.
Propriétés
Le point d'ébullition de H2O2 a été extrapolé à 150,2 ° C (302,4 ° F), environ 50 ° C (90 ° F) plus élevé que l'eau. En pratique, le peroxyde d'hydrogène subit une décomposition thermique potentiellement explosive lorsqu'il est chauffé à cette température. Il peut être distillé en toute sécurité à des températures plus basses sous pression réduite.
Le peroxyde d'hydrogène (H2O2) est une molécule non plane avec une symétrie C2 (tournée); cela a été démontré pour la première fois par Paul-Antoine Giguère en 1950 à l'aide de la spectroscopie infrarouge. Bien que la liaison O-O soit une liaison simple, la molécule a une barrière de rotation relativement élevée de 2460 cm -1 (29,45 kJ / mol); En comparaison, la barrière de rotation pour l'éthane est de 1040 cm -1 (12,5 kJ / mol). La barrière accrue est attribuée à la répulsion entre les paires isolées des atomes d'oxygène adjacents et résulte en un peroxyde d'hydrogène présentant une atropisomérie.
Les structures moléculaires du H2O2 gazeux et cristallin sont sensiblement différentes. Cette différence est attribuée aux effets de la liaison hydrogène, absente à l'état gazeux. Les cristaux de H2O2 sont tétragonaux avec le groupe spatial D44P4121.
Solutions aqueuses
Dans les solutions aqueuses, le peroxyde d'hydrogène diffère de la substance pure en raison des effets de la liaison hydrogène entre les molécules d'eau et de peroxyde d'hydrogène. Le peroxyde d'hydrogène et l'eau forment un mélange eutectique et présentent une dépression du point de congélation jusqu'à -56 ° C; l'eau pure a un point de congélation de 0 ° C et le peroxyde d'hydrogène pur de -0,43 ° C. Le point d'ébullition des mêmes mélanges est également réduit par rapport à la moyenne des deux points d'ébullition (125,1 ° C). Il se produit à 114 ° C. Ce point d'ébullition est 14 ° C supérieur à celui de l'eau pure et 36,2 ° C inférieur à celui du peroxyde d'hydrogène pur.
Applications
-Les apparences
Environ 60% de la production mondiale de peroxyde d'hydrogène est utilisée pour le blanchiment de la pâte et du papier. La deuxième application industrielle majeure est la fabrication de percarbonate de sodium et de perborate de sodium, qui sont utilisés comme agents de blanchiment doux dans les détergents à lessive. Le percarbonate de sodium, un adduit de carbonate de sodium et de peroxyde d'hydrogène, est l'ingrédient actif dans des produits de lessive tels que les détergents à lessive OxiClean et Tide. Lorsqu'il est dissous dans l'eau, il libère du peroxyde d'hydrogène et du carbonate de sodium. À eux seuls, ces agents de blanchiment ne sont efficaces qu'à des températures de lavage de 60 ° C (140 ° F) ou plus et sont donc souvent utilisés en conjonction avec des activateurs de blanchiment, qui facilitent le nettoyage à des températures plus basses.
-Production de composés organiques
Il est utilisé dans la production de divers peroxydes organiques, le peroxyde de dibenzoyle étant un exemple de volume élevé. Il est utilisé dans les polymérisations, comme agent de blanchiment de la farine et comme traitement de l'acné. Des peroxyacides, tels que l'acide peracétique et l'acide méta-chloroperoxybenzoïque, sont également produits avec du peroxyde d'hydrogène.
-Désinfectant
Le peroxyde d'hydrogène est utilisé dans certains procédés de traitement des eaux usées pour éliminer les impuretés organiques. Dans le traitement d'oxydation avancé, la réaction de Fenton produit le radical hydroxyle hautement réactif (OH). Cela dégrade les composés organiques, y compris ceux qui sont généralement robustes, tels que les composés aromatiques ou halogénés. Il peut également oxyder les composés soufrés des déchets; ce qui est bénéfique car il réduit généralement leur odeur.
Le peroxyde d'hydrogène peut être utilisé pour stériliser une variété de surfaces, y compris des outils chirurgicaux, et peut être utilisé sous forme de vapeur (VHP) pour la stérilisation dans la chambre. H2O2 a un large spectre d'activité contre les virus, les bactéries, les levures et les spores bactériennes. En général, une plus grande activité est observée contre les bactéries Gram positives que les bactéries Gram négatives; cependant, la présence de catalase ou d'autres peroxydases dans ces organismes peut augmenter la tolérance en présence de concentrations plus faibles. Des niveaux de concentration inférieurs (3%) agissent contre la plupart des spores; des concentrations plus élevées (7 à 30%) et des temps de contact plus longs amélioreront l'activité de destruction des spores.
Le peroxyde d'hydrogène est considéré comme une alternative écologique aux agents de blanchiment à base de chlore car il se décompose en oxygène et en eau et est largement reconnu comme un antimicrobien sûr aux États-Unis. Administration des aliments et des médicaments (FDA).
Le peroxyde d'hydrogène peut être utilisé pour traiter l'acné, bien que le peroxyde de benzoyle soit un traitement plus courant.
-Niche utilise
Le peroxyde d'hydrogène a plusieurs utilisations domestiques, principalement comme agent de nettoyage et de désinfection.
Décoloration des cheveux
Du H2O2 dilué (entre 1,9% et 12%) mélangé à de l'ammoniaque a été utilisé pour blanchir les cheveux humains. La propriété de blanchiment du produit chimique donne son nom au terme «peroxyde blond». Le peroxyde d'hydrogène est également utilisé pour le blanchiment des dents. On le trouve dans la plupart des dentifrices blanchissants. Le peroxyde d'hydrogène a montré des résultats positifs en ce qui concerne la légèreté des dents et les couleurs de chrominance. Il agit en oxydant les pigments colorés sur l'émail où la couleur de la dent peut s'éclaircir. Le peroxyde d'hydrogène peut être mélangé avec du bicarbonate de soude et du sel pour faire un dentifrice maison.
-Bâtons lumineux
Le peroxyde d'hydrogène réagit avec certains diesters, comme l'ester d'oxalate de phényle (cyalume), pour produire une chimioluminescence; cette application est la plus courante sous la forme de bâtons lumineux.
Horticulture
Certains jardiniers et utilisateurs de culture hydroponique préconisent l'utilisation d'une solution de peroxyde d'hydrogène faible dans les solutions aqueuses. La décomposition spontanée libère de l'oxygène qui facilite le développement des racines d'une plante et aide à traiter la pourriture des racines (mort cellulaire des racines due au manque d'oxygène) et une variété d'autres ravageurs.
-Tenue de la pêche
Le peroxyde d'hydrogène est utilisé en aquaculture pour contrôler la mortalité causée par divers microbes. En 2019, la FDA des États-Unis l'a approuvé pour le contrôle de la saprolegnose chez tous les poissons d'eau froide et tous les poissons juvéniles et les poissons adultes d'eau froide et d'eau chaude, pour le contrôle de la maladie externe de la colonne chez les poissons d'eau chaude et pour le contrôle de Gyrodactylus spp. chez les salmonidés d'élevage d'eau douce. Des tests en laboratoire menés par des pisciculteurs ont montré que le peroxyde d'hydrogène domestique commun peut être utilisé en toute sécurité pour oxygéner les petits poissons. Le peroxyde d'hydrogène libère de l'oxygène par décomposition lorsqu'il est exposé à des catalyseurs tels que le dioxyde de manganèse