Non ci sono articoli nel tuo carrello
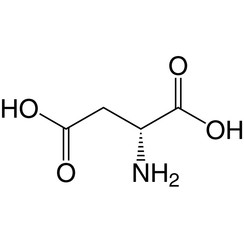
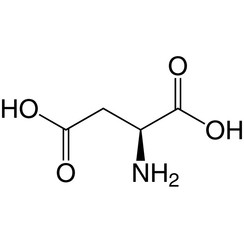
Acido aspartico
L'acido aspartico (simbolo Asp o D; la sua forma ionica è nota come aspartato), è un α-amminoacido utilizzato nella biosintesi delle proteine. Come tutti gli amminoacidi, contiene un gruppo amminico e un acido carbossilico. Il gruppo α-ammino si trova nel protonato –NH +
3 si forma in condizioni fisiologiche, mentre il suo gruppo acido α-carbossilico è deprotonato -COO- in condizioni fisiologiche. L'acido aspartico ha una catena laterale acida (CH2COOH) che reagisce con altri amminoacidi, enzimi e proteine nel corpo. In condizioni fisiologiche (pH 7,4) nelle proteine, la catena laterale di solito si presenta come la forma di aspartato caricato negativamente, −COO -. [5] È un amminoacido non essenziale negli esseri umani, il che significa che il corpo può sintetizzarlo secondo necessità. È codificato dai codoni GAU e GAC.
Il D-Aspartato è uno dei due D-amminoacidi che si trovano comunemente nei mammiferi.
Nelle proteine, le catene laterali dell'aspartato sono spesso legate all'idrogeno per formare giri asx o motivi asx, che spesso si verificano all'estremità N delle eliche alfa.
L'isomero L di Asp è uno dei 22 amminoacidi proteinogenici, ovvero i mattoni delle proteine. L'acido aspartico, come l'acido glutammico, è classificato come un amminoacido acido, con un pKa di 3,9, ma in un peptide è altamente dipendente dall'ambiente locale e può arrivare fino a 14. Asp è pervasivo nella biosintesi. Poiché l'aspartato può essere prodotto dall'organismo, è classificato come un amminoacido non essenziale.