U heeft geen artikelen in uw winkelwagen
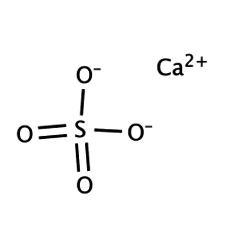
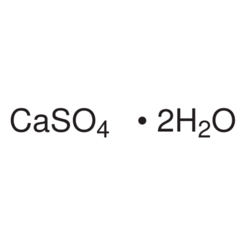
Calciumsulfaat
Calciumsulfaat is de anorganische verbinding met de formule CaSO4 en verwante hydraten. In de vorm van γ-anhydriet (de watervrije vorm) wordt het gebruikt als droogmiddel. Een bepaald hydraat is beter bekend als gips en een ander komt van nature voor als het minerale gips. Het heeft veel toepassingen in de industrie. Alle vormen zijn witte vaste stoffen die slecht oplosbaar zijn in water. Calciumsulfaat veroorzaakt blijvende hardheid in water.
Toepassingen
Het belangrijkste gebruik van calciumsulfaat is om gips en stucwerk te produceren. Deze toepassingen maken gebruik van het feit dat gepoederd en gecalcineerd calciumsulfaat na hydratatie een vormbare pasta vormt en hard wordt als kristallijn calciumsulfaatdihydraat. Het is ook handig dat calciumsulfaat slecht oplosbaar is in water en na het stollen niet gemakkelijk oplost in contact met water.
-Hydratatie en uitdroging reacties
Met voorzichtig verwarming wordt gips omgezet in het gedeeltelijk gedehydrateerde mineraal dat gips of gips van Parijs wordt genoemd. Dit materiaal heeft de formule CaSO4 · (nH2O), waarbij 0,5 ≤ n ≤ 0,8. Temperaturen tussen 100 en 150 ° C (212–302 ° F) zijn vereist om het water binnen zijn structuur te verdrijven. De details van de temperatuur en tijd zijn afhankelijk van de luchtvochtigheid. Temperaturen tot 170 ° C (338 ° F) worden gebruikt bij industriële calcinering, maar bij deze temperaturen begint γ-anhydriet te vormen. De warmte-energie die op dit moment aan het gips wordt geleverd (de warmte van hydratatie) heeft de neiging om water af te drijven (als waterdamp) in plaats van de temperatuur van het mineraal te verhogen, dat langzaam stijgt totdat het water is verdwenen en vervolgens sneller toeneemt . De vergelijking voor de gedeeltelijke uitdroging is:
CaSO4 · 2 H2O → CaSO4 · 1/2 H2O + 1 + 1/2 H2O ↑
De endotherme eigenschap van deze reactie is relevant voor de prestaties van gipsplaten, wat brandwerendheid verleent aan residentiële en andere constructies. Bij brand blijft de structuur achter een gipsplaat relatief koel omdat er water uit het gips verloren gaat, waardoor schade aan de lijst (door verbranding van houten delen of verlies van sterkte van staal bij hoge temperaturen) wordt voorkomen (of aanzienlijk wordt vertraagd). en bijgevolg structurele instorting. Maar bij hogere temperaturen zal calciumsulfaat zuurstof afgeven en als oxidatiemiddel werken. Deze eigenschap wordt gebruikt in aluminiumthermie. In tegenstelling tot de meeste mineralen, die bij rehydratatie eenvoudig vloeibare of halfvloeibare pasta's vormen of poederachtig blijven, heeft gecalcineerd gips een ongebruikelijke eigenschap: wanneer het wordt gemengd met water bij normale (omgevings-) temperaturen, keert het snel chemisch terug naar de gewenste dihydraatvorm, terwijl het fysiek "instelt" om een stijf en relatief sterk gipskristalrooster te vormen:
CaSO4 · 1/2 H2O + 1 + 1/2 H2O → CaSO4 · 2 H2O
Deze reactie is exotherm en is verantwoordelijk voor het gemak waarmee gips in verschillende vormen kan worden gegoten, waaronder vellen (voor gipsplaten), stokken (voor schoolbordkrijt) en vormen (om gebroken botten te immobiliseren of voor het gieten van metalen). Gemengd met polymeren, is het gebruikt als botreparatiecement. Kleine hoeveelheden gecalcineerd gips worden aan de aarde toegevoegd om direct uit gegoten aarde sterke structuren te creëren, een alternatief voor adobe (dat zijn kracht verliest als het nat is). De omstandigheden van uitdroging kunnen worden gewijzigd om de porositeit van het hemihydraat aan te passen, wat resulteert in de zogenaamde α- en β-hemihydraten (die min of meer chemisch identiek zijn).
Bij verwarming tot 180 ° C (356 ° F) wordt de bijna watervrije vorm, genaamd γ-anhydriet (CaSO4 · nH2O waarbij n = 0 tot 0,05) geproduceerd. γ-Anhydriet reageert langzaam met water om terug te keren naar de dihydraattoestand, een eigenschap die in sommige commerciële droogmiddelen wordt benut. Bij verhitting boven 250 ° C ontstaat de volledig watervrije vorm die β-anhydriet of "natuurlijk" anhydriet wordt genoemd. Natuurlijk anhydriet reageert niet met water, zelfs niet op geologische tijdschalen, tenzij zeer fijngemalen.
De variabele samenstelling van het hemihydraat en γ-anhydriet, en hun gemakkelijke onderlinge omzetting, is te danken aan hun bijna identieke kristalstructuren die "kanalen" bevatten die variabele hoeveelheden water kunnen opnemen, of andere kleine moleculen zoals methanol.
-Voedselindustrie
De calciumsulfaathydraten worden gebruikt als stollingsmiddel in producten zoals tofu.
Voor de FDA is het toegestaan in kaas en aanverwante kaasproducten; Graanmeel; Bakkerijproducten; Bevroren desserts; Kunstmatige zoetstoffen voor gelei en conserven; Kruiderij Groenten; en kruiderij tomaten en wat snoep.
Het is bekend in de E-nummerreeks als E516 en de FAO kent het als een verstevigingsmiddel, een meelbehandelingsmiddel, een sekwestreermiddel en een rijsmiddel.
-Andere gebruiken
Wanneer het in watervrije toestand wordt verkocht als droogmiddel met een kleurindicator onder de naam Drierite, lijkt het blauw (watervrij) of roze (gehydrateerd) door impregnatie met kobalt(II)chloride, dat fungeert als vochtindicator.
Tot de jaren zeventig werden in Whitehaven (Cumbria, VK) commerciële hoeveelheden zwavelzuur geproduceerd uit watervrij calciumsulfaat. Bij menging met schalie of mergel en geroosterd, maakt het sulfaat zwaveltrioxide vrij, een voorloper in de productie van zwavelzuur, de reactie produceert ook calciumsilicaat, een minerale fase die essentieel is bij de productie van cementklinkers.