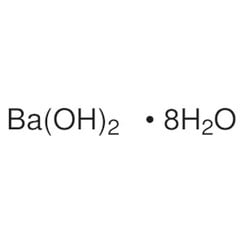U heeft geen artikelen in uw winkelwagen
Bariumhydroxide
Bariumhydroxide is een chemische verbinding met de chemische formule Ba(OH) 2(H2O) x. Het monohydraat (x = 1), bekend als bariet of barietwater, is een van de belangrijkste verbindingen van barium. Dit witte korrelige monohydraat is de gebruikelijke commerciële vorm.
Toepassingen
Industrieel wordt bariumhydroxide gebruikt als voorloper van andere bariumverbindingen. Het monohydraat wordt gebruikt om uit verschillende producten te dehydrateren en sulfaat te verwijderen. Deze toepassing maakt gebruik van de zeer lage oplosbaarheid van bariumsulfaat. Deze industriële toepassing wordt ook toegepast op laboratoriumtoepassingen.
-Laboratoriumgebruik
Bariumhydroxide wordt in de analytische chemie gebruikt voor de titratie van zwakke zuren, met name organische zuren. De heldere waterige oplossing is gegarandeerd vrij van carbonaat, in tegenstelling tot die van natriumhydroxide en kaliumhydroxide, aangezien bariumcarbonaat onoplosbaar is in water. Hierdoor kunnen indicatoren zoals fenolftaleïne of thymolftaleïne (met alkalische kleurveranderingen) worden gebruikt zonder het risico van titratiefouten als gevolg van de aanwezigheid van carbonaationen, die veel minder basisch zijn.
Bariumhydroxide wordt af en toe gebruikt in organische synthese als een sterke base, bijvoorbeeld voor de hydrolyse van esters en nitrilen en als base in aldolcondensaties.
Het is gebruikt om een van de twee equivalente estergroepen in dimethylhendecanedioaat te hydrolyseren.
Bariumhydroxide wordt ook gebruikt bij de decarboxylering van aminozuren die bariumcarbonaat daarbij vrijmaken.
Het wordt ook gebruikt bij de bereiding van cyclopentanon, diacetonalcohol en D-Gulonic γ-lacton.
Bariumhydroxide ontleedt tot bariumoxide bij verhitting tot 800 ° C. Reactie met kooldioxide geeft bariumcarbonaat. De waterige oplossing, die sterk alkalisch is, ondergaat neutralisatiereacties met zuren. Zo vormt het bariumsulfaat en bariumfosfaat met respectievelijk zwavelzuur en fosforzuur. Reactie met waterstofsulfide produceert bariumsulfide. Neerslag van veel onoplosbare of minder oplosbare bariumzouten kan het gevolg zijn van een dubbele vervangingsreactie wanneer een waterige bariumhydroxide-oplossing wordt gemengd met vele oplossingen van andere metaalzouten.
Reacties van bariumhydroxide met ammoniumzouten zijn sterk endotherm. De reactie van bariumhydroxide-octahydraat met ammoniumchloride of ammoniumthiocyanaat wordt vaak gebruikt als demonstratie in een klaslokaal, waarbij temperaturen worden geproduceerd die koud genoeg zijn om water te bevriezen en genoeg water om het resulterende op te lossen mengsel.