U heeft geen artikelen in uw winkelwagen
1,4-Dithiothreitol (DTT)
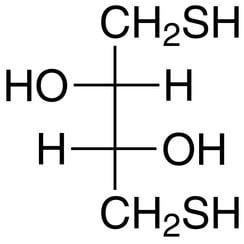
Dithiothreitol (DTT) is de algemene naam voor een redoxreagens met kleine moleculen, ook wel bekend als Cleland's reagens. De formule van Dithiothreitol is C4H10O2S2 en de chemische structuur van een van zijn enantiomeren in gereduceerde vorm wordt rechts weergegeven; de geoxideerde vorm is een disulfide-gebonden 6-ledige ring. Het reagens wordt vaak gebruikt in zijn racemische vorm, omdat beide enantiomeren reactief zijn. De naam is afgeleid van de vierkoolsuiker, threose. DTT heeft een epimere ('zus') verbinding, dithioerythritol (DTE)
DTT wordt gebruikt als reductiemiddel of "deprotecterende" stof voor thiolated DNA. De terminale zwavelatomen van gethioleerd DNA hebben de neiging dimeren in oplossing te vormen, vooral in aanwezigheid van zuurstof. Dimerisatie verlaagt de efficiëntie van daaropvolgende koppelingsreacties zoals DNA-immobilisatie op goud in biosensoren aanzienlijk. Typisch wordt Dithiothreitol gemengd met een DNA-oplossing, en wordt vervolgens verwijderd door filtratie (voor de vaste katalysator) of door chromatografie (voor de vloeibare vorm). De DTT-verwijderingsprocedure wordt vaak "ontzouten" genoemd. Over het algemeen wordt DTT gebruikt als een beschermend middel dat oxidatie van thiolgroepen voorkomt.
DTT wordt vaak gebruikt om de disulfidebindingen van eiwitten te verminderen en, meer in het algemeen, om te voorkomen dat intramoleculaire en intermoleculaire disulfidebindingen ontstaan tussen cysteïneresiduen van eiwitten. Maar zelfs DTT kan begraven (met oplosmiddel ontoegankelijke) disulfidebindingen niet verminderen, dus reductie van disulfidebindingen wordt soms uitgevoerd onder denaturerende omstandigheden (bijv. Bij hoge temperaturen of in aanwezigheid van een sterk denaturatiemiddel zoals 6 M guanidiniumchloride, 8 M ureum of 1% natriumdodecylsulfaat). DTT wordt vaak samen met natriumdodecylsulfaat in SDS-PAGE gebruikt om eiwitten verder te denatureren door hun disulfidebindingen te verminderen om een betere scheiding van eiwitten tijdens elektroforese mogelijk te maken. Vanwege het vermogen om disulfidebindingen te verminderen, kan DTT worden gebruikt om CD38 op rode bloedcellen te denatureren. Omgekeerd kan de blootstelling van verschillende disulfidebindingen aan het oplosmiddel worden bepaald door hun snelheid van afname in aanwezigheid van DTT.
DTT kan ook worden gebruikt als oxidatiemiddel. Het belangrijkste voordeel is dat er in feite geen gemengde disulfidesoorten worden bevolkt, in tegenstelling tot andere middelen zoals glutathion. In zeer zeldzame gevallen kan een DTT-adduct worden gevormd, d.w.z. de twee zwavelatomen van DTT kunnen disulfidebindingen vormen met verschillende zwavelatomen; in dergelijke gevallen kan DTT niet cycliseren omdat het dergelijke resterende vrije thiolen niet heeft