U heeft geen artikelen in uw winkelwagen
Luminol
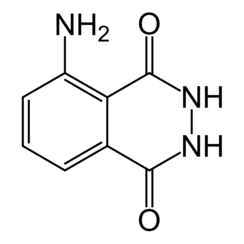
Luminol (C8H7N3O2) is een chemische stof die chemiluminescentie vertoont, met een blauwe gloed, wanneer gemengd met een geschikt oxidatiemiddel. Luminol is een wit tot lichtgele kristallijne vaste stof die oplosbaar is in de meeste polaire organische oplosmiddelen, maar onoplosbaar in water.
Forensische onderzoekers gebruiken luminol om sporen van bloed op misdaadscènes te detecteren, omdat het reageert met het ijzer in hemoglobine. Biologen gebruiken het in cellulaire testen om koper, ijzer, cyaniden en specifieke eiwitten te detecteren via western blotting.
Wanneer luminol gelijkmatig over een gebied wordt gespoten, zorgen sporen van een activerend oxidatiemiddel ervoor dat het luminol een blauwe gloed afgeeft die te zien is in een verduisterde kamer. De gloed duurt slechts ongeveer 30 seconden, maar onderzoekers kunnen het effect documenteren met een foto met een lange belichtingstijd. Onderzoekers van plaats delict moeten het gelijkmatig toepassen om misleidende resultaten te voorkomen, omdat bloedsporen meer geconcentreerd lijken in gebieden die meer besproeien. De intensiteit van de gloed geeft niet de hoeveelheid bloed of andere aanwezige activator aan, maar geeft alleen de verdeling van sporen in het gebied weer.
Om zijn luminescentie te laten zien, moet het luminol worden geactiveerd met een oxidatiemiddel. Gewoonlijk is een oplossing die waterstofperoxide (H2O2) en hydroxide-ionen in water bevat de activator. In aanwezigheid van een katalysator zoals een ijzer- of periodaatverbinding, ontleedt het waterstofperoxide om zuurstof en water te vormen:
2 H2O2 → O2 + 2 H2O
H2O2 + KIO4 → KIO3 + O2 + H2O
Laboratoriuminstellingen gebruiken vaak kaliumferricyanide of kaliumperjodaat voor de katalysator. Bij de forensische detectie van bloed is de katalysator het ijzer dat in hemoglobine aanwezig is. Enzymen in verschillende biologische systemen kunnen ook de afbraak van waterstofperoxide katalyseren.
Luminol reageert met het hydroxide-ion en vormt een dianion. De uit het waterstofperoxide geproduceerde zuurstof reageert dan met het luminol dianion. Het product van deze reactie, een organisch peroxide, is zeer onstabiel en ontleedt onmiddellijk met het verlies van stikstof om 5-aminoftaalzuur te produceren met elektronen in geëxciteerde toestand. Terwijl de aangeslagen toestand ontspant naar de grondtoestand, komt de overtollige energie vrij als een foton dat zichtbaar is als blauw licht