U heeft geen artikelen in uw winkelwagen
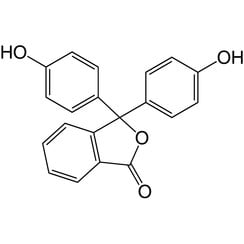
Fenolftaleïne
Fenolftaleïne is een chemische verbinding met de formule C20H14O4 en wordt in het kort geschreven als "HIn" of "phph". Fenolftaleïne wordt vaak gebruikt als indicator bij zuur-base titraties. Voor deze toepassing wordt het kleurloos in zure oplossingen en roze in basisoplossingen. Het behoort tot de klasse van kleurstoffen die bekend staat als ftaleïnekleurstoffen.
Fenolftaleïne is slecht oplosbaar in water en wordt meestal opgelost in alcoholen voor gebruik in experimenten. Het is een zwak zuur, dat H + -ionen in oplossing kan verliezen. Het fenolftaleïnemolecuul is kleurloos en het fenolftaleïne-ion is roze. Wanneer een base aan het fenolftaleïne wordt toegevoegd, verschuift het evenwicht, wat leidt tot meer ionisatie als H + -ionen worden verwijderd. Dit wordt voorspeld door het principe van Le Chatelier.
Toepassingen
-pH-indicator
Het algemeen gebruik van fenolftaleïne is een indicator bij zuur-base titraties. Het dient ook als een component van universele indicator, samen met methylrood, broomthymolblauw en thymolblauw.
Fenolftaleïne neemt ten minste vier verschillende toestanden aan in waterige oplossing als gevolg van pH-veranderingen. Onder sterk zure omstandigheden bestaat het in geprotoneerde vorm (HIn +), waardoor het een oranje kleur krijgt. Tussen sterk zure en licht basische omstandigheden is de lactonvorm (HIn) kleurloos. De dubbel gedeprotoneerde (In2-) fenolaatvorm (de anionvorm van fenol) geeft de bekende roze kleur. In sterk basale oplossingen wordt fenolftaleïne omgezet in zijn In (OH) 3-vorm en de roze kleur ondergaat een nogal langzame vervagende reactie en wordt volledig kleurloos boven 13,0 pH.
-Beton carbonatatie
De pH-gevoeligheid van fenolftaleïne wordt benut in andere toepassingen: beton heeft van nature een hoge pH vanwege het calciumhydroxide dat wordt gevormd wanneer Portland-cement reageert met water. Terwijl het beton in de atmosfeer met kooldioxide reageert, daalt de pH tot 8,5-9. Wanneer een 1% fenolftaleïne-oplossing op normaal beton wordt aangebracht, wordt deze helderroze. Als het echter kleurloos blijft, laat het zien dat het beton carbonatatie heeft ondergaan. In een vergelijkbare toepassing bevat een of andere spackling die wordt gebruikt om gaten in gipsplaat te repareren, fenolftaleïne. Bij het aanbrengen behoudt het basismateriaal van de verpakking een roze kleur; wanneer de spackling is uitgehard door reactie met atmosferisch kooldioxide, vervaagt de roze kleur.
-Educatief
In een zeer basische oplossing wordt de langzame verandering van fenolftaleïne van roze naar kleurloos als het wordt omgezet in zijn In (OH) 3-vorm gebruikt in scheikundelessen voor de studie van reactiekinetiek.
-Entertainment
Fenolftaleïne wordt gebruikt in speelgoed, bijvoorbeeld als onderdeel van verdwijnende inkt, of verdwijnende verf op het haar van Hollywood Hair Barbie. In de inkt wordt het gemengd met natriumhydroxide, dat reageert met koolstofdioxide in de lucht. Deze reactie leidt ertoe dat de pH onder de kleurveranderingsdrempel komt wanneer waterstofionen vrijkomen door de reactie:
OH− (aq) + CO2 (g) → CO2−
3 (aq) + H + (aq).
Om het haar en "magische" grafische patronen te ontwikkelen, wordt de inkt besproeid met een oplossing van hydroxide, wat leidt tot het verschijnen van de verborgen afbeeldingen door hetzelfde mechanisme dat hierboven is beschreven voor kleurverandering in alkalische oplossing. Door de reactie met kooldioxide verdwijnt het patroon uiteindelijk weer. Thymolftaleïne wordt voor hetzelfde doel en op dezelfde manier gebruikt, wanneer een blauwe kleur gewenst is.
-Medisch gebruik
Fenolftaleïne wordt al meer dan een eeuw gebruikt als laxeermiddel, maar wordt nu verwijderd uit vrij verkrijgbare laxeermiddelen vanwege bezorgdheid over carcinogeniteit. Laxerende producten die voorheen fenolftaleïne bevatten, zijn vaak opnieuw geformuleerd met alternatieve actieve ingrediënten: Feen-a-Mint schakelde over op bisacodyl en Ex-Lax werd overgeschakeld naar een senna-extract.
Thymolphthalein is een verwant laxeermiddel gemaakt van thymol.
Ondanks bezorgdheid over de carcinogeniteit ervan, is het onwaarschijnlijk dat het gebruik van fenolftaleïne als laxeermiddel eierstokkanker veroorzaakt. Van fenolftaleïne is gevonden dat het de cellulaire calciuminstroom van de mens remt via calciuminvoer in de winkel (SOCE, zie Activering van calciumafgiftekanaal § Structuur). Dit wordt bewerkstelligd door de remmende trombine en thapsigargin, twee activatoren van SOCE die het intracellulaire vrije calcium verhogen.
Fenolftaleïne is toegevoegd aan de kandidatenlijst van de European Chemicals Agency voor zeer zorgwekkende stoffen (SVHC). [14]
Een gereduceerde vorm van fenolftaleïne, fenolftaline, die kleurloos is, wordt gebruikt in een test om stoffen te identificeren waarvan wordt aangenomen dat ze bloed bevatten, algemeen bekend als de Kastle-Meyer-test. Een droog monster wordt verzameld met een wattenstaafje of filtreerpapier. Een paar druppels alcohol, dan een paar druppels fenolftaline en tot slot een paar druppels waterstofperoxide op het monster gedruppeld. Als het monster hemoglobine bevat, wordt het onmiddellijk roze na toevoeging van het peroxide, vanwege de vorming van fenolftaleïne. Een positieve test geeft aan dat het monster hemoglobine bevat en daarom waarschijnlijk bloed is. Een vals positief resultaat kan het gevolg zijn van de aanwezigheid van stoffen met een katalytische activiteit die vergelijkbaar is met hemoglobine. Deze test is niet destructief voor het monster; het kan worden bewaard en gebruikt bij verdere tests. Deze test heeft dezelfde reactie met bloed van elk dier waarvan het bloed hemoglobine bevat, inclusief bijna alle gewervelde dieren; verder testen zou nodig zijn om te bepalen of het afkomstig was van een mens.
Fenolftaleïne kan worden gemaakt door condensatie van ftaalzuuranhydride met twee equivalenten fenol onder zure omstandigheden (vandaar de naam). Het werd in 1871 ontdekt door Adolf von Baeyer.
De reactie kan ook worden gekatalyseerd door een mengsel van zinkchloride en thionylchloride.