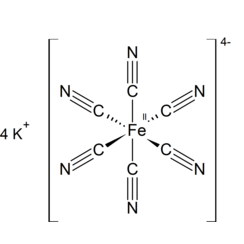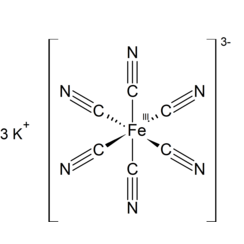U heeft geen artikelen in uw winkelwagen
Kaliumhexacyanoferraat
Kaliumferricyanide, kaliumhexacyanoferraat of rood bloedloogzout is de chemische verbinding met de formule K3 [Fe (CN) 6]. Dit knalrode zout bevat het octaëdrisch gecoördineerde [Fe (CN) 6] 3− ion. [2] Het is oplosbaar in water en de oplossing vertoont wat groen-gele fluorescentie. Het werd in 1822 ontdekt door Leopold Gmelin, en werd aanvankelijk gebruikt bij de productie van ultramarijn kleurstoffen.
De verbinding wordt op grote schaal gebruikt in blauwdruktekeningen en in fotografie (Cyanotype-proces). Bij verschillende fotografische printtonen wordt gebruik gemaakt van kaliumferricyanide. Kaliumferricyanide werd gebruikt als oxidatiemiddel om zilver tijdens de verwerking van kleurnegatieven en positieven te verwijderen, een proces dat bleken wordt genoemd. Omdat bleekmiddelen van kaliumferricyanide milieuonvriendelijk zijn, van korte duur zijn en in staat zijn cyaanwaterstofgas af te geven als ze met zuur worden gemengd, worden bleekmiddelen met ferri-EDTA sinds de introductie van het Kodak C-41-proces in 1972 bij de kleurverwerking gebruikt. In kleurenlithografie wordt kaliumferricyanide gebruikt om de grootte van kleurstippen te verkleinen zonder het aantal te verminderen, als een soort handmatige kleurcorrectie die puntetsen wordt genoemd. Het wordt ook gebruikt in zwart-witfotografie met natriumthiosulfaat (hypo) om de dichtheid van een negatief of gelatinezilverdruk te verminderen, waarbij het mengsel bekend staat als Farmer's reductiemiddel; dit kan helpen bij het oplossen van problemen als gevolg van overbelichting van het negatief, of kan de highlights in de afdruk helderder maken.
De verbinding wordt ook gebruikt om ijzer en staal te harden, bij het galvaniseren, het verven van wol, als laboratoriumreagens en als een mild oxidatiemiddel in de organische chemie.
Kaliumferricyanide is ook een van de twee verbindingen die aanwezig zijn in ferroxylindicatoroplossing (samen met fenolftaleïne) die blauw wordt (Pruisisch blauw) in aanwezigheid van Fe2 + -ionen, en die daarom kan worden gebruikt om metaaloxidatie te detecteren die tot roest zal leiden. Het is mogelijk om het aantal mol Fe2 + -ionen te berekenen met behulp van een colorimeter, vanwege de zeer intense kleur van Pruisisch blauw Fe4 [Fe (CN) 6] 3.
Kaliumferricyanide wordt vaak gebruikt in fysiologische experimenten als middel om het redoxpotentiaal van een oplossing (E ° '~ 436 mV bij pH 7) te verhogen. Als zodanig kan het gereduceerd cytochroom c (E ° '~ 247 mV bij pH 7) oxideren in intacte geïsoleerde mitochondriën. Natriumdithioniet wordt bij dergelijke experimenten gewoonlijk als reductiemiddel gebruikt (E ° '~ -420 mV bij pH 7).
kaliumhexacyanoferraat wordt gebruikt om het ferri-reducerende vermogen van een monster (extract, chemische verbinding, enz.) Te bepalen. Een dergelijke meting wordt gebruikt om de antioxiderende eigenschap van een monster te bepalen.
Kaliumferricyanide wordt in veel amperometrische biosensoren gebruikt als een elektronoverdrachtsmiddel dat het natuurlijke elektronoverdrachtsmiddel van een enzym, zoals zuurstof, vervangt zoals bij het enzym glucose-oxidase. Het wordt gebruikt als dit ingrediënt in veel in de handel verkrijgbare bloedglucosemeters voor gebruik door diabetici.
Kaliumferricyanide wordt gecombineerd met kaliumhydroxide (of natriumhydroxide als vervanging) en water om het etsmiddel van Murakami te formuleren. Dit etsmiddel wordt gebruikt door metallografen om contrast te bieden tussen bindmiddel- en carbidefasen in gecementeerde carbiden.
-Pruisisch blauw
Pruisisch blauw, het diepblauwe pigment in blauwdruk, wordt gegenereerd door de reactie van K3 [Fe (CN) 6] met ferro (Fe2 +) -ionen en K4 [Fe (CN) 6] met ijzerzouten.
In de histologie wordt kaliumferricyanide gebruikt om ferro-ijzer in biologisch weefsel te detecteren. Kaliumferricyanide reageert met ferro-ijzer in zure oplossing om het onoplosbare blauwe pigment te produceren, gewoonlijk aangeduid als Turnbull-blauw of Pruisisch blauw. Om ijzer (Fe3 +) ijzer te detecteren, wordt kaliumferrocyanide gebruikt in plaats van de Pruisische blauwe kleuringsmethode van Perls. Het materiaal gevormd in de blauwe reactie van de Turnbull en de verbinding gevormd in de Pruisische blauwe reactie zijn hetzelfde.